编者按:表观遗传失调是抗肿瘤治疗中细胞免疫逃逸的重要特征之一,针对表观遗传调控靶点的探索有望提高肿瘤对免疫治疗的敏感性,增强免疫检查点抑制剂的疗效。来自麻省理工学院-哈佛大学Broad研究所、麻省总医院、布列根和妇女医院的研究人员利用CRISPR-Cas9技术在动物模型中对影响免疫检查点抑制剂疗效的表观遗传调控因子进行了筛选,发现H3K9甲基转移酶SETDB1或许在肿瘤免疫逃逸过程中发挥重要作用,该蛋白有望成为免疫治疗的候选靶点。该项研究的成果最新发表在期刊Nature上。
表观遗传学在抗肿瘤领域的应用
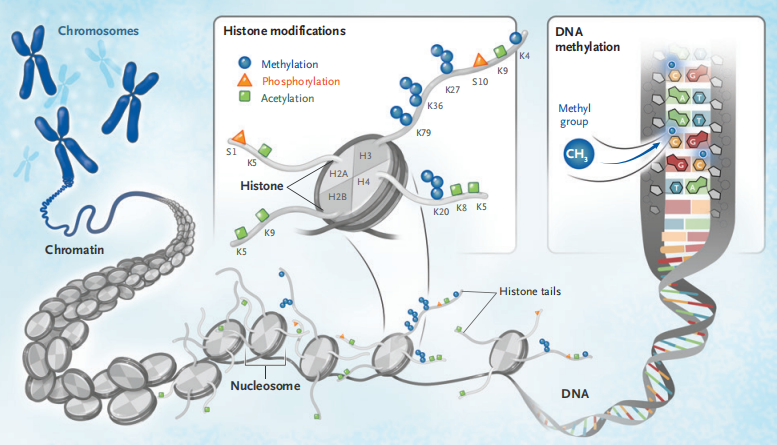
免疫检查点抑制剂的问世颠覆了许多类型肿瘤的标准疗法。免疫检查点抑制剂能够协同人体免疫系统杀灭肿瘤细胞,但是仅能对部分肿瘤患者产生疗效。肿瘤细胞可以利用各种分子途径来逃避免疫系统的追击,如通过表观遗传修饰的改变关闭一些基因的表达。这种表观遗传学的改变与肿瘤的免疫应答密切相关,但目前我们对其具体机制的了解仍十分有限。
目前获批的抗肿瘤表观遗传药物有DNMT抑制剂阿扎胞苷、地西他滨;IDH2抑制剂Enasidenib、IDH1抑制剂Ivosidenib;EZH2抑制剂Tazemetostat;HDAC抑制剂西达本胺、Vorinostat、Romdepsin、Belinostat以及Panobinostat等,这些国内外获批的抗肿瘤表观遗传药物主要集中在血液肿瘤,在实体瘤中仍有广阔的探索空间。
此外,表观遗传药物与经典化疗、靶向药物、其他表观遗传药物以及免疫检查点抑制剂的联合应用有望产生协同作用,增加肿瘤患者的反应率,当前有多项DNMT、HDAC或EZH2抑制剂联合免疫检查点抑制剂的研究正在进行。
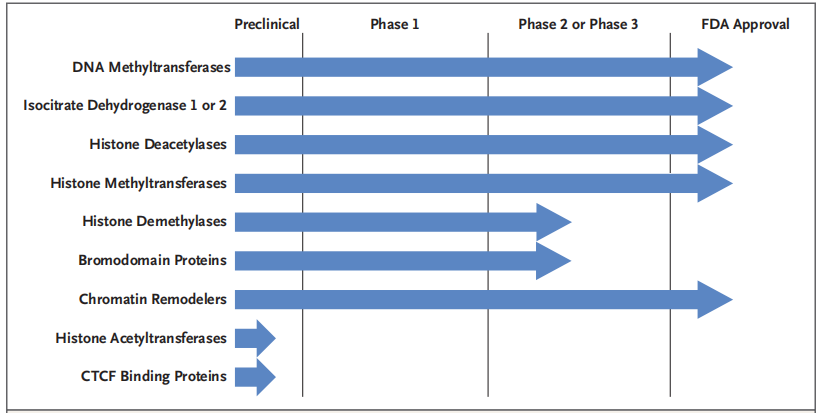 图2:在研或获FDA批准的表观药物
图2:在研或获FDA批准的表观药物
为了寻找可以增加免疫检查点抑制剂的治疗敏感性的表观遗传调控因素,来自麻省理工学院-哈佛大学Broad研究所、麻省总医院、布列根和妇女医院的研究人员利用基因编辑技术有系统地分别在肿瘤细胞中删除近1000种表观遗传调控因子,并将这些不同的肿瘤细胞分别植入小鼠模型中给予免疫检查点抑制剂治疗,评估删除哪些基因能使肿瘤细胞对免疫治疗更为敏感。研究结果表明,很少有SETDB1基因缺失的肿瘤细胞能够在药物治疗下生存,这表明SETDB1基因或许能帮助肿瘤细胞逃避免疫系统的识别。
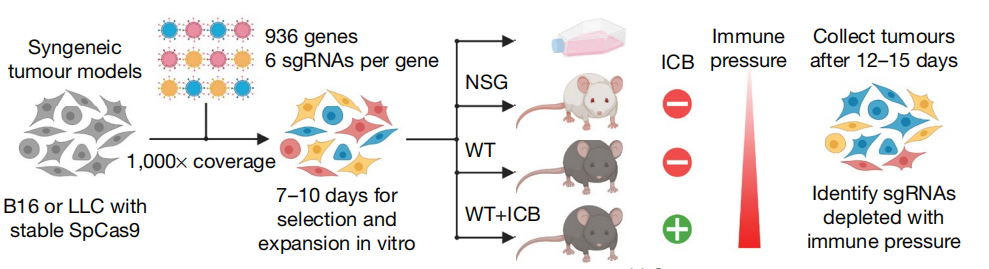
当研究人员在小鼠肿瘤模型中阻断SETDB1蛋白,免疫疗法对肿瘤细胞的杀伤作用得以增强,在免疫检查点抑制剂的作用下,肿瘤明显缩小。此外,TCGA数据库中的患者队列数据进一步支持了这个发现,SETDB1基因的扩增与过表达不仅与免疫豁免型肿瘤的形成密切相关,且同样与晚期肾细胞癌PD-1单抗疗效不佳有关。
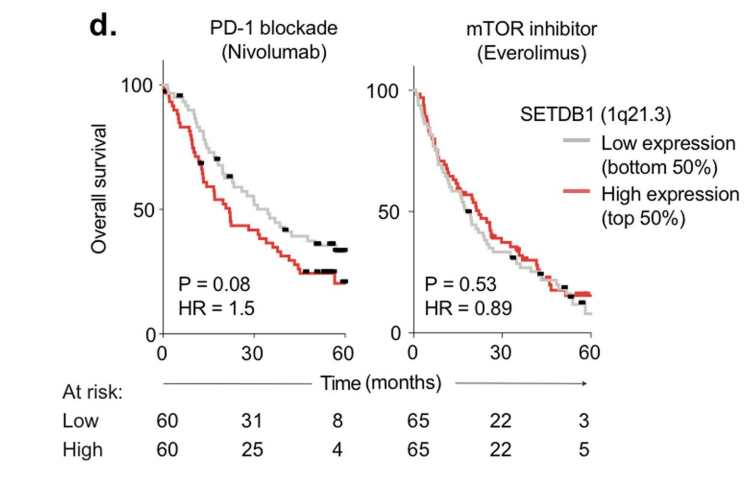
图4:SETDB1基因扩增/过表达与肾细胞癌患者生存
随后,研究人员探索了SETDB1基因是如何对肿瘤细胞免疫应答产生影响的。他们发现敲除SETDB1基因能引起大量转座子产生RNA和蛋白,并且促进免疫细胞与肿瘤细胞的结合。转座子是细胞中能改变自身位置的一段DNA序列(即跳跃基因),可能为人类进化过程中病毒残留遗传物质镶嵌进人类基因组中形成。阻断SETDB1蛋白促进了这些“病毒蛋白”的表达,而由于这些病毒蛋白更易被免疫系统识别,因此当肿瘤细胞开始表达这些序列时,免疫系统能够通过新抗原更好的识别肿瘤细胞,免疫检查点抑制剂的作用得以增强。
我们知道,免疫疗法对许多肿瘤患者无效,其中原因之一就是肿瘤细胞表面缺乏让免疫系统识别的靶点。如果能够诱导肿瘤细胞产生新的免疫系统可以识别的靶点,或许会有更多患者在免疫治疗中获益。
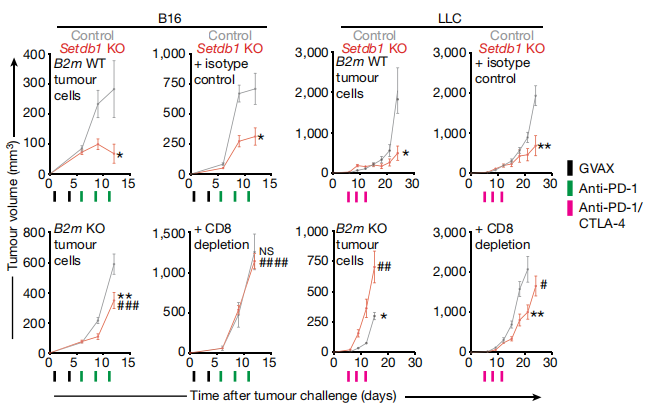
此外,值得关注的是,敲除SETDB1基因同样能够刺激其相关结构域免疫刺激性基因的扩增,快速激活免疫反应。SETDB1基因一方面通过沉默转座子起到表观遗传调节作用,一方面通过影响相邻区域的免疫相关基因影响免疫治疗疗效,这两条不同的途径都对抗肿瘤免疫治疗具有重要影响。这项研究可能为抗肿瘤免疫治疗揭示了潜在的新的药物靶点。
1. Bates, S. E. (2020). Epigenetic therapies for cancer. New England Journal of Medicine, 383(7), 650-663.2. Griffin, G.K., Wu, J., Iracheta-Vellve, A. et al. Epigenetic silencing by SETDB1 suppresses tumour intrinsic immunogenicity. Nature (2021). https://doi.org/10.1038/s41586-021-03520-4 




 京公网安备 11010502033352号
京公网安备 11010502033352号