编者按:BTK抑制剂是近年来淋巴瘤治疗领域的又一里程碑式药物,极大改善了淋巴瘤患者的生存和结局。在获得良好反应率的同时,BTK抑制剂常不可避免地发生不同程度感染事件,影响了药物的应用和疗效的维持。本期《新“淋”视角》特别栏目采访到浙江大学医学院附属第二医院血液内科主任钱文斌教授,请钱教授就临床上常见的淋巴瘤患者相关的感染事件、发生机制、以及后续管理进行讲解,以期能够指导BTK抑制剂在临床中的应用,从而造福更多淋巴瘤患者。
《肿瘤瞭望》:B细胞淋巴瘤患者免疫功能低下,有感染的风险,且接受BTK抑制剂后感染也是常见的不良反应之一。您能否介绍一下淋巴瘤患者常见的感染类型及感染的发生机制?
钱文斌教授:由于淋巴瘤患者的免疫功能处于异常状态,因此非常容易感染,包括以下几种类型:首先是真菌感染:侵袭性真菌感染(IFI)主要是由环境中无处不在的丝状真菌( 曲霉菌、毛霉菌和镰刀菌等) 、新生隐球菌及肺孢子菌等引发的机会性感染。一项单中心的回顾性研究表明,在33例接受伊布替尼治疗、并同时发生IFI的患者中,有27例(81%)患者的病原体是曲霉菌[1]。目前已确定的与曲霉菌感染相关的特殊风险因素包括合并使用皮质类固醇、既往多线化疗、糖尿病和肝病[2-4]。
关于真菌感染的发生机制:在正常生理条件下,人体感染曲霉菌后,会通过巨噬细胞炎症反应清除曲霉感染,在此过程中BTK介导的信号通路的激活起了非常关键的作用[4]。伊布替尼等作为BTK介导的信号通路抑制剂,可抑制曲霉菌感染后巨噬细胞的激活[5],抑制活化T细胞的核因子(NFAT)和核因子κB(NF-κB)的核转运,从而阻碍中性粒细胞召募,阻止肿瘤坏死因子-α(TNF-α)的产生并抑制半乳甘露聚糖的产生[6-7],这些因素导致了曲霉感染不易被清除。除BTK外,伊布替尼还不可逆地抑制白介素-2(IL-2)诱导T细胞特异激酶(ITK) ,ITK在T细胞成熟和炎症反应中发挥重要作用[8]。当ITK受到抑制时,CD4+T细胞不能有效转化为辅助型T细胞2(Th2)效应细胞,无法对肺孢子菌、隐球菌等病原体产生应答进而引发真菌感染[8]。
另一种在慢性淋巴细胞白血病(CLL)患者中需要关注的特殊感染是卡氏肺囊虫。卡氏肺囊虫肺炎又称卡氏肺孢子虫肺炎、肺孢子菌肺炎,是一种非典型的真菌感染,主要累及免疫低下的人群。在临床上,不少淋巴瘤患者经过相关化疗药物与相关免疫抑制剂治疗后,极易并发卡氏肺孢子虫肺炎。据文献报道,接受伊布替尼治疗的其他血液恶性肿瘤患者的卡氏肺囊虫感染发生率明显低于CLL患者[9],这表明卡氏肺囊虫病的感染风险可能与基础疾病的免疫抑制有关,而与药物本身无关[10]。
第二类常见感染是病毒感染:《中国淋巴瘤合并HBV感染患者管理专家共识》指出,淋巴瘤合并乙型肝炎病毒 (HBV)感染的患者在接受化疗或免疫抑制治疗时,可能会诱发HBV再激活[11]。HBV再激活一方面会增加患者的肝炎发病率及相关病死率,另一方面可能会导致针对淋巴瘤的有效治疗中断从而间接影响患者生存及预后[12]。但患者使用BTK抑制剂后发生HBV再激活的机制目前尚不明确[13]。
另外,关于感染与BTK抑制剂脱靶效应之间的关系:一些BTK抑制剂在治疗过程中由于不能高选择性抑制靶点,因此除了抑制BTK激酶外还有可能抑制ITK激酶[14]。在人体免疫过程中,T细胞介导的细胞免疫是抗肿瘤免疫的主要免疫反应。ITK作为非受体型酪氨酸激酶Tec家族成员之一,在T细胞系中特异性表达,并在T细胞信号通路中起着重要作用,可调节人体的免疫功能[15]。因此一旦ITK激酶表达受到抑制,也会进一步增加患者在接受BTK抑制剂治疗后发生感染的风险。
奥布替尼是新近获得中国国家药监局批准上市的新型BTK抑制剂,其相关的感染事件发生率较低。在2020年第62届ASH大会上,abstract 1140对5项有关奥布替尼单药治疗淋巴瘤患者的临床研究进行了安全性汇总分析[16]。结果表明:在266例患者中,41例患者(15.4%)发生≥3级感染;最常见的感染为上呼吸道感染和肺部感染。大多数不良事件发生在早期治疗期间,新事件的发生频率在后期周期内显著降低。相较于既往报道的其他BTK抑制剂≥3级的感染发生率,奥布替尼≥3级以上的感染发生率最低[16](图1)。奥布替尼治疗B细胞淋巴瘤感染发生率低可能是因为患者接受奥布替尼治疗后快速起效,免疫功能重建,降低感染风险。2020年AACR大会上发表的一项临床前/I期研究结果[17]显示:由于奥布替尼在结构上进行了优化,因此具有高靶点选择性、良好的PK/PD特性以及较大的安全性窗口,且奥布替尼对于感染相关靶点(ITK)的IC50(nM)值较大,抑制ITK的效果较弱,因此能够最大程度降低感染等相关不良事件的发生(图2)。
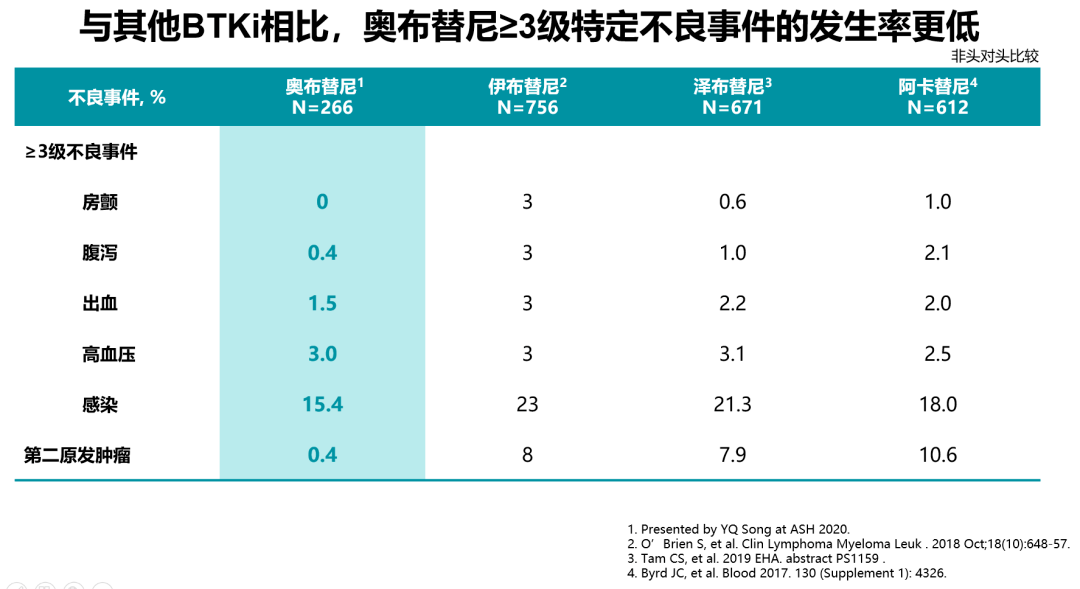
图1.各类BTK抑制剂的不良事件发生率[16]
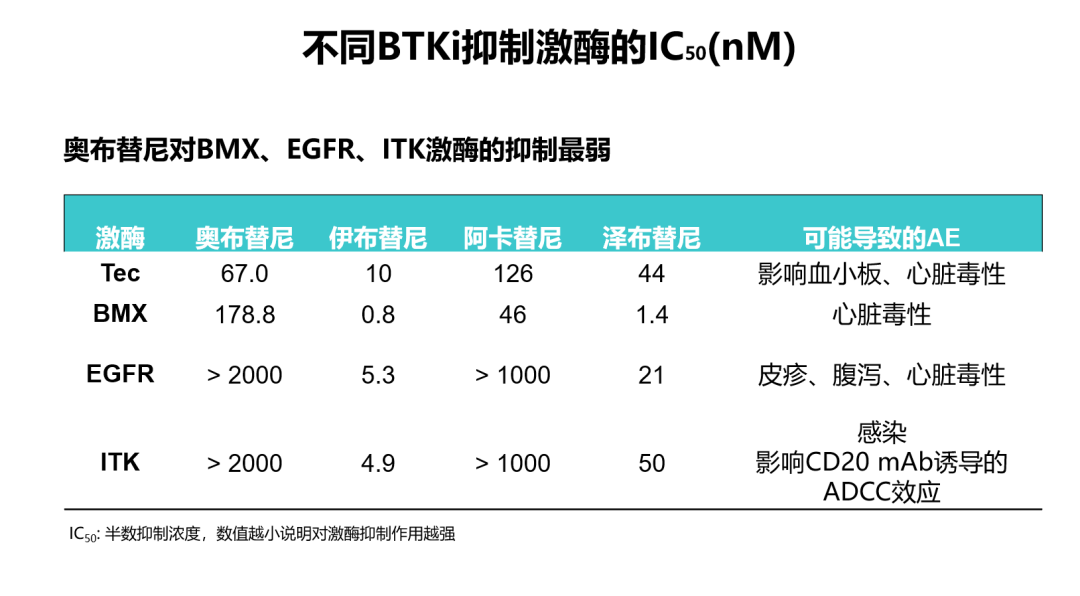
图2.不同BTK抑制剂抑制不同激酶的IC50
《肿瘤瞭望》:BTK抑制剂是当前治疗B细胞淋巴瘤,如CLL/SLL、MCL等的重要药物之一,但感染作为其常见的不良事件,引起了广泛关注。那么,接受BTK抑制剂治疗后多久会发生感染?应如何处理感染,是否需要进行药物剂量调整?
钱文斌教授:首先,关于治疗相关感染出现的时间:接受BTK抑制剂治疗的患者大多在6个月内会发生感染,且感染发生率随着时间的推移逐步降低[18-19]。
其次,对于感染的管理,以新型BTK抑制剂奥布替尼为例,对于奥布替尼用药前有严重感染的患者,需在感染得到有效控制后才能开始服用奥布替尼。当发生3级及以上的感染时,应暂停奥布替尼直至感染得到有效控制。对于机会性感染风险增加的患者,应考虑根据标准治疗进行预防。在治疗期间应检测和评估患者是否出现发热或其他感染的症状和体征,并给予相应治疗,同时密切关注抗感染药物与奥布替尼的药物相互作用。
同时,对于不同类型的感染源,应采取不同的治疗策略:
对于真菌性感染:在患者接受BTK抑制剂治疗期间,真菌感染的管理尤其具有挑战性。曲霉菌的最佳治疗包括使用唑类药物治疗,如伏立康唑、泊沙康唑或伊曲康唑。伏立康唑是治疗IFI的首选药物,由于其组织穿透性强,能透过血脑屏障,也可用于中枢神经系统真菌感染的治疗。然而,在临床实践中,并发IFI的患者通常需要长时间停用伊布替尼直至感染完全控制。原因是由于伊布替尼与抗真菌药物伏立康唑、泊沙康唑等强效CYP3A4抑制剂均有显著的药物相互作用,与伊布替尼联用后可使伊布替尼暴露量增加,导致不良事件发生,因此应避免联用。如必须使用CYP3A4抑制剂治疗感染时,应注意按照说明书调整伊布替尼剂量[20-21]。当感染得到有效控制后,患者可继续服用伊布替尼,以期获得最佳临床疗效[21-22]。
艾沙康唑是一种新型三唑类抗真菌药物,具有抗菌谱广、生物利用度高、可预测的线性药动学性质等优点。与其他三唑类药物相比,艾沙康唑是中效CYP3A4抑制药,与其他药物的相互作用较弱,可替代伏立康唑进行抗真菌治疗[23]。
其他抗真菌药, 如两性霉素B和棘白菌素类对伊布替尼的代谢无影响,也可以与伊布替尼联合使用,但需要注意药物本身副作用[20]。
对于乙型肝炎病毒感染:淋巴瘤患者在接受BTK抑制剂治疗过程中发现不少乙型肝炎病毒再激活的报告[13]。对于患者而言,应在使用BTK抑制剂前明确乙型肝炎病毒状态。若患者目前或既往有乙型肝炎病毒感染,建议在接受治疗前咨询肝炎专科医师,并依据当地诊疗常规监测管理,以防止乙型肝炎复发。如果患者为乙型肝炎核心抗体阳性,则须接受预防性抗乙型肝炎病毒治疗;同时注意检测HBV DNA水平,如果水平升高,通常伴随着肝功能损伤[12,24]。
最后,对于肺感染的高风险患者:高龄、既往有肺部基础疾病、既往接受多线化疗、免疫功能低下,或既往反复发生肺感染的患者,应注意卡氏肺孢子虫肺炎发生。
《肿瘤瞭望》:BTK抑制剂是B细胞淋巴瘤,如CLL/SLL、MCL等疾病治疗的重要药物,感染是其常见的不良事件,那么临床上是否可以采取预防措施来降低感染的发生风险?
钱文斌教授:首先,对于真菌感染的预防:《2019版伊布替尼治疗B细胞恶性肿瘤中国专家共识》[24]认为,由于一代BTK抑制剂伊布替尼与抗真菌药物伏立康唑和泊沙康唑等中、强效CYP3A4抑制剂均有显著的药物相互作用,因此并不推荐预防性抗真菌治疗。尽管近期的一些研究强调了常规预防卡氏肺孢子肺炎的重要性[25-26],但是由于数据有限,国际CLL工作组并未特殊推荐常规预防卡氏肺孢子肺炎[27],而临床实践中各个中心也未达成一致。《中国慢性淋巴细胞白血病/小淋巴细胞淋巴瘤的诊断与治疗指南(2018年版)》[28]对于感染预防的建议为:对于反复感染且IgG<5 g/L 的CLL患者,需进行静脉注射丙种球蛋白(IVIG)使IgG维持≥5 g/L水平。
其次,对于HBV再激活的预防:国内外研究发现,对于接受利妥昔单抗联合化疗的患者,化疗前采用预防性抗病毒治疗可有效预防HBV再激活[29-30]。在有关化疗患者预防HBV再激活的文献中,所采用的药物大多为拉米夫定 (lamivudine),其安全性和有效性已得到证实[31-33]。然而拉米夫定的主要问题是其耐药率很高[34-35]。考虑到化疗过程中HBV再激活患者的相关死亡率很高,因此推荐有条件者尽可能采用高效、低耐药的抗病毒药物进行预防。恩替卡韦(entecavir)和替诺福韦酯(tenofovir disoprox)均为强效抗病毒药物,且耐药率极低,是颇具前景的预防用药新选择[36-37]。
综上所述,由于B细胞淋巴瘤患者常常处于免疫功能异常状态,因此发生各种细菌、真菌以及病毒等感染的风险要明显高于正常人。BTK抑制剂因其对免疫功能有抑制作用,感染是其相对常见的副作用,临床医生应该提高警惕,早期发现,早期处理。当患者发生感染事件时,需要根据感染的严重程度、病原学证据、原发病类型、患者的免疫状态以及药物间的相互作用等多种因素进行综合考虑,对原发病的治疗方案以及抗感染药物作及时调整。
[1] Ghez D, Calleja A, Protin C, et al; French Innovative Leukemia Organization (FILO) CLL group. Early-onset invasive aspergillosis and other fungal infections in patients treated with ibrutinib. Blood. 2018;131(17):1955-1959.
[2] Lionakis MS, Dunleavy K, Roschewski M, et al. Inhibition of B cell receptor signaling by ibrutinib in primary CNS lymphoma. Cancer Cell. 2017;31(6):833-843.e5.[3] Rogers KA, Luay M, Zhao Q, et al. Incidence and type of opportunistic infections during ibrutinib treatment at a single academic center [abstract]. Blood. 2017;130(suppl 1). Abstract 830.[4] Woyach JA. Ibrutinib and Aspergillus: a Btk-targeted risk. Blood. 2018 Nov 1;132(18):1869-1870. doi: 10.1182/blood-2018-08-865659. PMID: 30385492.[5] Borge M, Bel ?en Almej ?un M, Podaza E, et al. Ibrutinib impairs the phago- cytosis of rituximab-coated leukemic cells from chronic lymphocytic leukemia patients by human macrophages. Haematologica. 2015;100(4): e140-e142.[6] Bercusson A, Colley T, Shah A, Warris A, Armstrong-James D. Ibrutinib blocks Btk-dependent NF-?B and NFAT responses in human macrophages during Aspergillus fumigatus phagocytosis. Blood. 2018;132(18):1985-1988.[7] Bercusson A, Colley T, Shah A, Warris A, Armstrong-James D. Ibrutinib blocks Btk- dependent NF-?B and NFAT responses in human macrophages during Aspergillus fumigatus phagocytosis. Blood. 2018;132(18): 1985-1988.[8] Dubovsky JA, Beckwith KA, Natarajan G, et al. Ibrutinib is an irreversible molecular inhibitor of ITK driving a Th1-selective pressure in T lymphocytes. Blood. 2013;122(15):2539-2549.[9] Ahn IE, Jerussi T, Farooqui M, Tian X, Wiestner A, Gea-Banacloche J. Atypical Pneumocystis jirovecii pneumonia in previously untreated patients with CLL on single-agent ibrutinib. Blood.2016;128(15):1940-1943.[10] Cheng MP, Kusztos AE, Gustine JN, et al. Low risk of Pneumocystis jirovecii pneumonia and invasive aspergillosis in patients with Waldenstro ? macroglobulinaemia on ibrutinib [published online ahead of print 20 November 2018]. Br J Haematol. doi:10.1111/ bjh.15627.[11] 中华医学会血液学分会, 中国抗癌协会淋巴瘤专业委员会, 中华医学会肝病学分会. 中国淋巴瘤合并HBV感染患者管理专家共识 [J] . 中华血液学杂志,2013,34 (11): 988-993. DOI: 10.3760/cma.j.issn.0253-2727.2013.11.019[12] Molica S, Levato L, Mirabelli R, Tedeschi A, Lentini M. Feasibility and safety of therapy with ibrutinib after antiviral control of hepatitis B virus (HBV) reactivation in chronic lymphocytic leukemia patients. Leuk Lymphoma. 2018 Nov;59(11):2734-2736. doi: 10.1080/10428194.2018.1436175. Epub 2018 Feb 21. PMID: 29465275.[13] Innocenti I, Morelli F, Autore F, Corbingi A, Pasquale R, Sorà F, Pompili M, Laurenti L. HBV reactivation in CLL patients with occult HBV infection treated with ibrutinib without viral prophylaxis. Leuk Lymphoma. 2019 May;60(5):1340-1342. doi: 10.1080/10428194.2018.1523401. Epub 2019 Feb 7. PMID: 30730231.[14] Berglöf A, Hamasy A, Meinke S, Palma M, Krstic A, Månsson R, Kimby E, Österborg A, Smith CI. Targets for Ibrutinib Beyond B Cell Malignancies. Scand J Immunol. 2015 Sep;82(3):208-17. doi: 10.1111/sji.12333. PMID: 26111359; PMCID: PMC5347933.[15] Dubovsky JA, Beckwith KA, Natarajan G, Woyach JA, Jaglowski S, Zhong Y, Hessler JD, Liu TM, Chang BY, Larkin KM, Stefanovski MR, Chappell DL, Frissora FW, Smith LL, Smucker KA, Flynn JM, Jones JA, Andritsos LA, Maddocks K, Lehman AM, Furman R, Sharman J, Mishra A, Caligiuri MA, Satoskar AR, Buggy JJ, Muthusamy N, Johnson AJ, Byrd JC. Ibrutinib is an irreversible molecular inhibitor of ITK driving a Th1-selective pressure in T lymphocytes. Blood. 2013 Oct 10;122(15):2539-49. doi: 10.1182/blood-2013-06-507947. Epub 2013 Jul 25. PMID: 23886836; PMCID: PMC3795457.[16] Yuqin Song, Wei Xu, Yongping Song, Lihong Liu, Song Lin, Zhiming Li, Ting Liu, Shuhua Yi, Daobin Zhou, Mingzhi Zhang, Yu Hu, Jie Jin, Huaqiang Zhu, Zhengguang Lu, Renbin Zhao, Zhixin Xu, Jun Zhu; Pooled Analysis of Safety Data from Clinical Trials of Orelabrutinib Monotherapy in Hematologic Malignancies. Blood 2020; 136 (Supplement 1): 43. doi: https://doi.org/10.1182/blood-2020-140172[17] Abstract CT132: Orelabrutinib, a potent and selective Bruton’s tyrosine kinase inhibitor with superior safety profile and excellent PK/PD properties. Bin Zhang, Renbin Zhao, Ruixia Liang, Yingxiang Gao, Richard Liu, Xiangyang Chen, Zhengguang Lu, Zuopeng Wang, Liqin Yu, Sepehr Shakib and Jisong Cui. Cancer Res August 15 2020 (80) (16 Supplement) CT132; DOI: 10.1158/1538-7445.AM2020-CT132[18] Byrd JC, Furman RR, Coutre SE, et al. Three- year follow-up of treatment-na ??ve and pre- viously treated patients with CLL and SLL receiving single-agent ibrutinib. Blood. 2015; 125(16):2497-2506.[19] Sun C, Tian X, Lee YS, et al. Partial reconstitution of humoral immunity and fewer infections in patients with chronic lymphocytic leukemia treated with ibrutinib. Blood. 2015; 126(19):2213-2219.[20] Stephens DM, Byrd JC. How I manage ibrutinib intolerance and complications in patients with chronic lymphocytic leukemia. Blood. 2019 Mar 21;133(12):1298-1307. doi: 10.1182/blood-2018-11-846808. Epub 2019 Jan 14. PMID: 30642919; PMCID: PMC6428663.[21] Brown JR. How I treat CLL patients with ibrutinib. Blood. 2018 Jan 25;131(4):379-386. doi: 10.1182/blood-2017-08-764712. Epub 2017 Dec 18. PMID: 29255067.[22] Rogers KA, Mousa L, Zhao Q, Bhat SA, Byrd JC, El Boghdadly Z, Guerrero T, Levine LB, Lucas F, Shindiapina P, Sigmund AM, Sullivan M, Wiczer TE, Woyach JA, Awan FT. Incidence of opportunistic infections during ibrutinib treatment for B-cell malignancies. Leukemia. 2019 Oct;33(10):2527-2530. doi: 10.1038/s41375-019-0481-1. Epub 2019 May 13. PMID: 31086260; PMCID: PMC7425823.[23] Bradbeer CS, Thin RN. Comparison of econazole and isoconazole as single dose treatment for vaginal candidosis. Genitourin Med. 1985 Dec;61(6):396-8. doi: 10.1136/sti.61.6.396. PMID: 3910548; PMCID: PMC1011868.[24] 中国临床肿瘤学会(CSCO)抗白血病联盟, 中国临床肿瘤学会(CSCO)抗淋巴瘤联盟. 伊布替尼治疗B细胞恶性肿瘤中国专家共识(2019年版)[J] . 白血病·淋巴瘤,2019,28 (8): 449-456. DOI: 10.3760/cma.j.issn.1009-9921.2019.08.001[25] Rogers KA, Mousa L, Zhao Q, et al. Incidence of opportunistic infections during ibrutinib treatment for B-cell malignancies. Leukemia. 2019;33(10): 2527-2530.[26] Ryan CE, Cheng MP, Issa NC, Brown JR, Davids MS. Pneumocystis jirovecii pneumonia and institutional prophylaxis practices in CLL patients treated with BTK inhibitors. Blood Adv. 2020;4(7):1458-1463.[27] Hallek M, Cheson BD, Catovsky D, et al. iwCLL guidelines for diagnosis, indications for treatment, response assessment, and supportive man- agement of CLL. Blood. 2018;131(25):2745-2760.[28] 中华医学会血液学分会白血病淋巴瘤学组, 中国抗癌协会血液肿瘤专业委员会, 中国慢性淋巴细胞白血病工作组. 中国慢性淋巴细胞白血病/小淋巴细胞淋巴瘤的诊断与治疗指南(2018年版) [J] . 中华血液学杂志,2018,39 (5): 353-358. DOI: 10.3760/cma.j.issn.0253-2727.2018.05.001[29] Matsue K, Kimura S, Takanashi Y, et al. Reactivation of hepatitis B virus after rituximab-containing treatment in patients with CD20-positive B-cell lymphoma. Cancer 2010;116:4769-4776.[30] Yeo W, Chan TC, Leung NW, et al. Hepatitis B virus reactivation in lymphoma patients with prior resolved hepatitis B undergoing anticancer therapy with or without rituximab. J Clin Oncol 2009;27:605-611.[31] Lau GKK, Yiu HHY, Fong DYT, et al. Early is superior to deferred preemptive lamivudine therapy for hepatitis B patients undergoing chemotherapy. Gastroenterology 2003;125:1742-1749.[32] Tsutsumi Y, Tanaka J, Kawamura T, et al. Possible efficacy of lamivudine treatment to prevent hepatitis B virus reactivation due to rituximab therapy in a patient with non-Hodgkin’s lymphoma. Ann Hematol 2004;83:58-60.[33] Ziakas PD, Karsaliakos P, Mylonakis E. Effect of prophylactic lamivudine for chemotherapy-associated hepatitis B reactivation in lymphoma: a meta-analysis of published clinical trials and a decision tree addressing prolonged prophylaxis and maintenance. Haematologica 2009;94:998-1005.[34] Law JK, Ali JA, Harrigan PR, et al. Fatal postlymphoma chemotherapy hepatitis B reactivation secondary to the emergence of a YMDD mutant strain with lamivudine resistance in a noncirrhotic patient. Am J Hematol 2006;81:969-972.[35] Schnepf N, Sellier P, Bendenoun M, et al. Reactivation of lamivudine-resistant occult hepatitis B in an HIV-infected patient undergoing cytotoxic chemotherapy. J Clin Virol 2007;39:48-50.[36] Huang YH, Hsiao LT, Hong YC, et al. Randomized controlled trial of entecavir prophylaxis for rituximab-associated hepatitis B virus reactivation in patients with lymphoma and resolved hepatitis B. J Clin Oncol 2013;31:2765-2772.[37] Huang H, Li X, Zhu J, et al. Entecavir vs lamivudine for prevention of hepatitis B virus reactivation among patients with untreated diffuse large B-cell lymphoma receiving R-CHOP chemotherapy: a randomized clinical trial. JAMA 2014;312:2521-2530.
浙江大学医学院附属第二医院血液内科 主任
浙江大学血液病研究所 副所长
中国老年保健协会淋巴瘤专业委员会 副主任委员
中国抗癌协会血液肿瘤专业委员会 委员
淋巴瘤学组 副组长
CSCO中国抗淋巴瘤联盟专家委员会 委员
中国研究型医院学会罕见病分会 常务理事
浙江省医学会血液学分会 侯任主委
浙江省医师协会血液医师分会 副会长
以第一/通讯作者在Leukemia、Mol Cancer Ther、J Hematol Oncol、Br J Haematol等国际知名刊物发表SCI论文50余篇
主持国家自然基金重点项目1项和面上项目4项、国家重点研发计划精准医学研究重点专项子课题、国家科技支撑计划子课题和浙江省重点研发计划等
作为负责人或主要成员获得国家科技进步二等奖2项、省科技进步一、二等奖近10项
?





 京公网安备 11010502033352号
京公网安备 11010502033352号