导读:众所周知,肿瘤的诊疗经历了经验医学时代、循证医学时代,如今到达精准医学时代。多基因检测这一手段的出现,使得以分子分型为基础的乳腺癌诊疗策略更加精准和精细化。本期《肿瘤瞭望》邀请到了福建省立医院肿瘤外科的叶松青教授,请他为我们讲解目前我国早期乳腺癌多基因检测的选择与困惑。
早期乳腺癌多基因检测(multi-gene assay,MGA)简介及分类
乳腺癌多基因检测是指在分子分型的基础上,通过检测乳腺癌肿瘤组织标本中与肿瘤细胞生长调控相关的若干个代表性基因的表达水平,进行量化、建立相应的数学模型,从而区分同一分子亚型乳腺癌的不同预后并进行疗效预测,指导辅助治疗决策。早期乳腺癌(EBC)多基因检测的价值在于:避免过度医疗、预测复发风险、指导治疗决策。
EBC常见的多基因检测工具包括Oncotype DX、MammaPrint、Breast Cancer Index(BCI)、EndoPredict(EP)、PAM50、28基因、GGI等。前5种多基因检测模型已被NCCN 2018指南列为辅助治疗临床决策的重要依据。第八版《AJCC肿瘤分期》在保留传统解剖学分期的同时,也把21基因检测列为预后分期I类证据。2019年CSCO指南及今年EBCC大会上欧洲指南共识都推荐21基因和70基因检测用于早期乳腺癌辅助治疗前的评估。对于EBC多基因检测工具的选择,应了解多基因研究的设计方式及其研究入组人群特征。
Oncotype DX(21基因)
回顾性的NSABP B-14及NSABP-20等研究都告诉我们,早期乳腺癌21基因可预测10年复发风险,OncotypDx RS 评分评越高,复发风险越高,化疗获益越显著,当然需要更高级别的前瞻性研究去验证它的有效性。
TAILORx III期试验是首个针对21基因价值的大样本前瞻性研究。TAILORx基本入组标准为:
浸润性乳腺癌女性,18-75岁
淋巴结阴性,ER和/或PR阳性,HER2阴性
肿瘤1.1cm-5.0cm(或0.6cm-1.0cm且Grade中高级)

TAILORx研究结果显示:RS分值在11-25分之间的患者,不论是主要研究终点iDFS还是次要研究终点DRFI,单纯内分泌治疗组都不劣于内分泌联合化疗组(HR 1.08,P=0.26;HR 1.03,P=0.80)。亚组分析结果提示:≤50岁且RS 16-25分患者,不能豁免化疗。
对于1-3枚淋巴结转移的绝经后乳腺癌患者,SWOG 8814 III期随机对照研究共纳入367例患者,评估了单用他莫昔芬或化疗序贯他莫昔芬或化疗同步他莫昔芬治疗绝经后ER/PR+、淋巴结阳性乳腺癌患者的疗效。结果显示,仅接受他莫昔芬内分泌治疗人群中,RS有预后价值,低危组(RS<18)未显示化疗获益。同样,在Plan B研究中15.3%的病例(N0-1)RS<11分,仅接受内分泌治疗的5年DFS可达94%。
2020年10月,Breast Cancer Res Treat在线发表的对美国全国癌症数据库2010~2016年间28591例大数据回顾分析结果表明,对于年龄≤70岁、淋巴结分期为N1的激素受体阳性HER2阴性乳腺癌患者,即使复发评分为12~25,临床医师考虑不化疗时也应谨慎,期待2020年初RxPONDER前瞻性研究结果。
MammaPrint(70基因)
MINDACT III期前瞻性试验,以Adjuvant! Online v8.0临床病理系统来确定临床风险,以70基因检测确定基因风险。

MINDACT研究入组标准如下:
年龄18-70岁;
病理确认的浸润性乳腺癌;
T分期为:T1,或T2,或可手术的T3;
要求入组患者淋巴结阴性;2009年8月后,标准扩大到≤3个淋巴结阳性;
无远处转移。
2016年MINDACT试验初次分析结果:主要终点:C-High/G-Low组不化疗的患者中,5年DMFS为94.7%(95%Cl:92.5%~96.2%),可信区间下界大于92%,达到主要研究终点。
次要终点
C-High/G-Low组中,化疗组较不化疗组的5年DMFS获益增加约1.5%(95.9% vs 94.4%,校正后HR=0.78,95% CI:0.50~1.21,P=0.27)。
C-Low/G-High组,化疗带来的DMFS获益更小(95.8% vs 95.0%,校正后HR=1.17,P=0.66)。
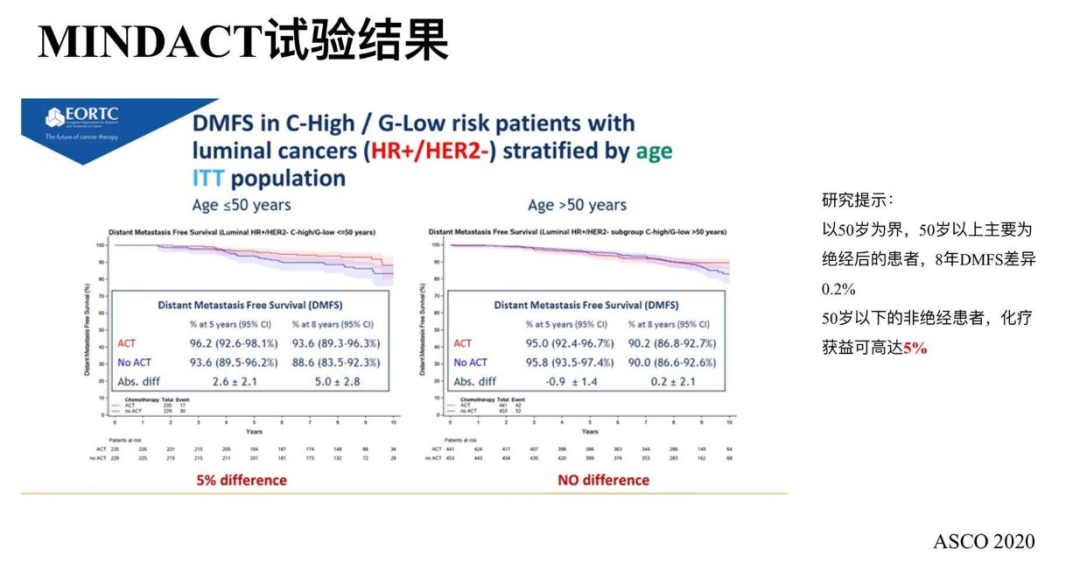
2020ASCO中位随访8.7年结果显示,C-High/G-Low组中不化疗的患者,更新后5年的主要研究终点DMFS为95.1%(95%Cl:93.1%~96.6%),可信区间下界仍然大于92%,整组人群的持续阳性结果。次要研究终点:C-High/G-Low组,化疗与不化疗相比8年的数据更新后:5年DMFS差异为0.9%;8年DMFS差异则轻度增大为2.6%,虽然差异依然没有统计学意义,但是研究者探索了到底哪些人群可能化疗更大获益。
探索性研究提示:以50岁为界,50岁以上主要为绝经后的患者,8年DMFS差异0.2%。50岁以下的非绝经患者,化疗获益可高达5%。虽然不是预设的亚组分析,但仍然带给我们重要启示,我们需要考量临床特征,比如年龄因素。
Breast Cancer Index(BCI)
2019ASCO发布的Trans-Attom是一项多中心、前瞻-回顾性研究,应用乳腺癌指数BCI(Breast Cancer Index)预测三苯氧胺辅助内分泌治疗HR阳性乳腺癌患者的获益和远期远处复发风险,结果表明:BCI高的HR+、N+早期患者,能够从10年和5年TAM治疗中显著获益预测准确性优于21基因 RS和IHC4,可作为延长内分泌治疗受益的预测性生物标志物。
EndoPredict(EP)
EP是针对于ER阳性、HER2阴性乳腺癌患者的复发风险预测模型,检测12个和复发转移相关基因的表达水平,以计算基因决定的风险(EP部分),然后结合患者的肿瘤大小和淋巴结状况(Clin部分),最后得到综合评分(即EP Clin),能预测长达10年的复发风险,指导5年后的内分泌治疗,有研究提示其预测能力要优于21基因检测。
PAM50
PAM50包含了50个分类裁定基因与5个对照基因,基于50个相关基因的表达量,测算个体化的复发风险,也就是 PAM50 ROR(Risk Of Recurrence)工具,该工具对术后10年内复发概率做出评分,其分值为0-100,分值越高,复发风险越高。在设计之初用于乳腺癌分型,后发展用于复发风险评估分层。
28基因
28基因检测工具是2003年我国台湾自主研发的,针对亚洲人群的研究,囊括18个关键基因+10个辅助基因,同时涵盖了肿块的大小、年龄、淋巴结状态、病理分级、脉管有无癌栓等临床指标进行综合的检测分析,最后得出病人为高风险或低风险的判断,它能够评估患者远处转移风险,以及局部复发风险,这是21基因检测工具和70基因检测工具所不具备的功能。当然需要积累更多数据。
多基因检测在新辅助治疗中的应用
2019年,Breast Cancer Res Treat 发表的TransNEOS是一项运用Oncotype DX评分作为新辅助内分泌治疗(24-28周的来曲唑)疗效预测的研究,在ER+/HER2-、LN-的绝经后人群中,RS分值<18分占53%,获得的完全或部分缓解率为54%,疾病进展率为1%;而RS分值≥31分占19%,获得完全或部分缓解率为22%,疾病进展率为17%。提示RS评分低的患者,可能新辅助内分泌治疗效果较好。
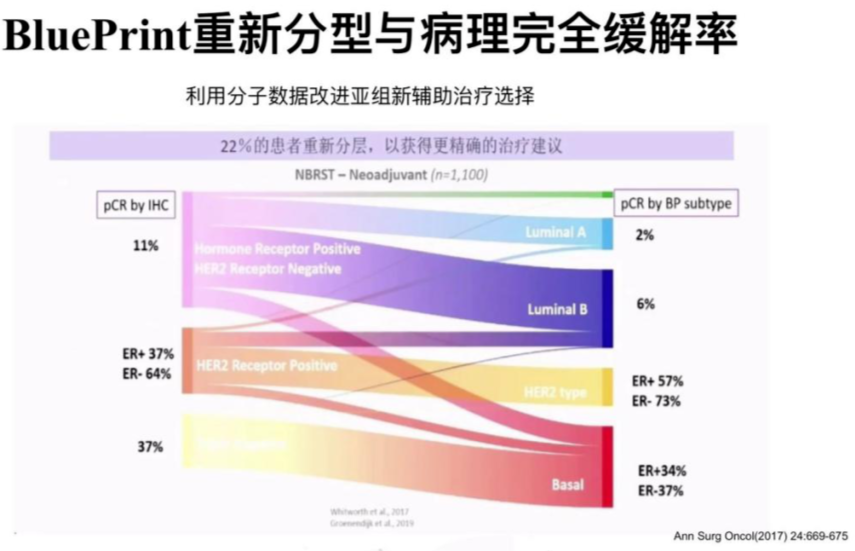
2020中美乳腺论坛的相关报道来源于两个临床研究数据,NBRST Trial、I-SPY,利用BluePrint重新分型,22%患者重新分层后,获得更精准治疗建议。MammaPrint +BluePrint精细划分适合不同治疗决策的人群,改进新辅助治疗的选择。目前,强调要重视新辅助治疗早期疗效动态评估,对于是否需要再往前移,在新辅助治疗开始前进行新辅疗效的判断,多基因检测或许能帮助到我们。
21基因、70基因检测是否可用于HER2+乳腺癌和三阴性乳腺癌?
答案基本是否定的,21基因检测相关研究没有入组三阴性乳腺癌或HER2+人群,70基因主要针对HR阳性病人研究,不推荐用于三阴性乳腺癌和HER2+乳腺癌(90%-96%基因高风险,治疗逻辑也很难规避化疗)。
70基因对HER2+型需慎重,仅限于可能预测复发风险(约20%基因低风险且预后较好),老年或合并心脏基础疾病或小肿瘤(T1a)治疗减法的参考,没有数据支持用于术后临床治疗决策。
如何选择多基因预判ER+近期/远期复发风险?
判断复发风险有临床病理LN,T,G,Age等参数以及一些风险预测模型。如St. Gallen风险评估分层、CTS5预测模型及网络预测工具(Adjuvant Online!)等,基因工具也可以帮助我们选择,近期复发风险:21基因, 70基因, BCI, PAM50, EPClin。远期复发风险:BCI,PAM50,EPClin。
是否化疗,多基因检测与临床指标谁更重要?
临床指标更普适用、更重要。不管是21基因还是70基因,不能完全独立于临床指标而存在,譬如年龄就是一个重要因素,基因也不能充分考量肿瘤微环境及宿主个体反应,必须与临床指标相结合。
如何选择21基因与70基因?
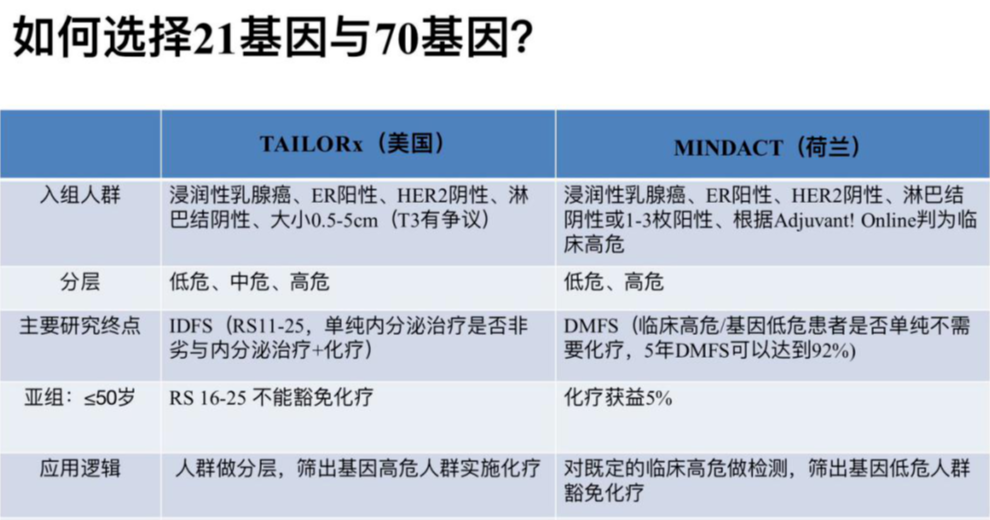
1、给不给化疗,21基因做参考,非常明确的治疗决策面前,不需要做。
2、应用70基因的基本前提是,患者必须为临床高危。
3、50岁以下临床高危患者,70基因检测实际价值有限,70基因可能对于50岁以上的绝经后患者更有价值。
4、70基因的优势主要在绝经后淋巴结转移1-3枚的患者,想豁免化疗时可以选择;分高、低风险两层,免除中风险患者的不确定性。
5、对于淋巴结阴性,21基因和70基因都是可选的,只不过两者的应用逻辑不同,目前并无证据证明21基因和70基因在化疗获益的预测方面,哪一个效力更优?
多基因检测(MGA)在化疗中的价值?
2019年的一项荟萃分析探讨MGA在化疗中的应用价值,对早期可手术HR阳性乳腺癌的MGA 进行了成本效益分析。该荟萃分析共纳入了31项临床研究,12202例患者,其中大多数(86.1%)使用21基因检测来确定复发风险,其他的MGA模型包括70基因、50基因和12基因。
结果显示:
与不做MGA检测相比,MGA检测增加了临床高危患者化疗使用率,降低了5%-10%临床低危患者化疗使用率。
与不做检测相比,应用MGA来指导临床决策,降低了约29%远处转移发生风险。
应用21基因检测还可以缩减医疗成本。
多基因检测目前存在的问题?
?21基因对粘液癌的特殊类型乳腺癌的检测价值?
?70基因检测,1枚淋巴结转移和3枚转移?相似预测作用?
?1-2枚前哨淋巴结活检阳性,可以进行多基因检测以豁免化疗吗?
?仅有70基因在中国获得批准,21基因无正版授权 。
?基因表达差异,人种问题。
?检测质量标准化,不同的多基因检测工具一致性评价问题?
?前瞻性研究数据不足。
?费用、可及性、成本效益的问题。

结 语
多基因检测主要目的和价值是评估预后和预测疗效,使乳腺癌辅助治疗的诊疗策略更加精准和精细化。国内外指南推荐21基因、70基因检测用于早期乳腺癌辅助治疗前的评估,选择需要个体化考量。早期乳腺癌辅助治疗决策最重要的影响因素,依然是患者准确的临床和病理信息,多基因检测须与临床病理特征相结合,以保证结果准确性和可靠性。多基因检测仍有许多未决的问题,需要更多积累、探索和研究,以提供支持改变决策的结果数据。
多基因检测指导乳腺癌诊疗策略的的时代真的到来了吗?我国多基因检测水平足够成熟了吗?化疗做减法切实可行吗?目前来看,对于这些问题的回答依然任重而道远!
专家简介
 ?
?
叶松青
福建省立医院肿瘤外科主任医师
福建省立医院肿瘤外科行政副主任
福建省医学会乳腺病学分会副主任委员
中国抗癌协会乳腺癌专业委员会委员
CSCO乳腺癌专家委员会委员
中国医师协会肿瘤医师分会乳腺癌学组委员
海峡两岸医药卫生交流协会肿瘤防治专家委员会常务委员





 京公网安备 11010502033352号
京公网安备 11010502033352号