日前,拟于在加拿大多伦多举办的第51届美国妇科肿瘤学会(SGO)年会因新冠疫情影响,被迫取消线下会议。SGO官网公布会议摘要内容,本文就大会公布的卵巢癌相关摘要进行了整理,供读者学习。
1、【34 – Seminal Abstracts】Maintenance olaparib plus bevacizumab (bev) after platinum-based chemotherapy plus bev in patients (pts) with newly diagnosed advanced high-grade ovarian cancer (HGOC): Efficacy by timing of surgery and residual tumor status in the Phase III PAOLA-1 trial
新诊断晚期高级别卵巢癌患者接受铂类及贝伐单抗化疗后进行奥拉帕利联合贝伐单抗维持治疗的III期PAOLA-1研究:手术时机和术后残留肿瘤状态对疗效的影响。
目的:在PAOLA-1/ENGOT-OV25(NCT01844986)研究中,在一线含铂药物联合贝伐珠单抗的化疗后,使用PARP抑制剂奥拉帕利联合贝伐珠单抗作为维持治疗,可使晚期高级别卵巢癌患者的无进展生存期(PFS)获得统计学显著的改善(HR=0.59,95%CI 0.49-0.72)。本研究通过分析手术时机和术后残留肿瘤状态来评估奥拉帕利联合贝伐珠单抗维持治疗的疗效。
方法:PAOLA-1是一项随机、双盲、III期试验,适用于新诊断的FIGO III-IV期、高级别浆液性或子宫内膜样卵巢癌、输卵管癌或原发性腹膜癌患者。患者接受含铂药物联合贝伐珠单抗的化疗,达到临床完全或部分缓解后,被随机分为奥拉帕利 (300mg片剂,bid,最多24个月)+贝伐珠单抗(15 mg/kg q3w,共15个月)或安慰剂+贝伐珠单抗组,按一线化疗结果和肿瘤BRCA突变状态分层分析。主要研究终点为研究者评估的PFS,并用盲法独立中心审查进行敏感性分析。参照实体肿瘤改良反应评估标准(RECIST v1.1)进行评估。
结果:共有537名患者被随机分为奥拉帕利联合贝伐珠单抗组和269名安慰剂联合贝伐珠单抗组。中位随访时间为22.9个月。其中,51%的患者接受早期减瘤术,42%的患者接受间歇性手术。在所有患者中,60%术后无残留病灶,33%术后存在肉眼可见的残留病灶,7%的患者未接受手术治疗。早期减瘤术患者的PFS为:奥拉帕利+贝伐珠单抗 vs 安慰剂+贝伐珠单抗:29.6个月 vs 18.2个月HR=0.52 (95%CI 0.40~0.69);间歇性减瘤术患者的PFS为:奥拉帕利+贝伐珠单抗 vs安慰剂+贝伐珠单抗:21.4个月 vs 16.7个月,HR=0.66 (95%CI 0.50~0.87)。术后无肉眼残留病灶患者的PFS为:奥拉帕利+贝伐珠单抗 vs安慰剂+贝伐珠单抗:29.6个月 vs 19.3个月 HR=0.54 (95%CI 0.42~0.71);有肉眼残留病灶患者的PFS为:奥拉帕利+贝伐珠单抗 vs安慰剂+贝伐珠单抗:18.2个月 vs 12.9个月,HR=0.63 (95%CI 0.47~0.85)。结合手术时机、残留肿瘤状态及疾病分期的分析结果如表所示。
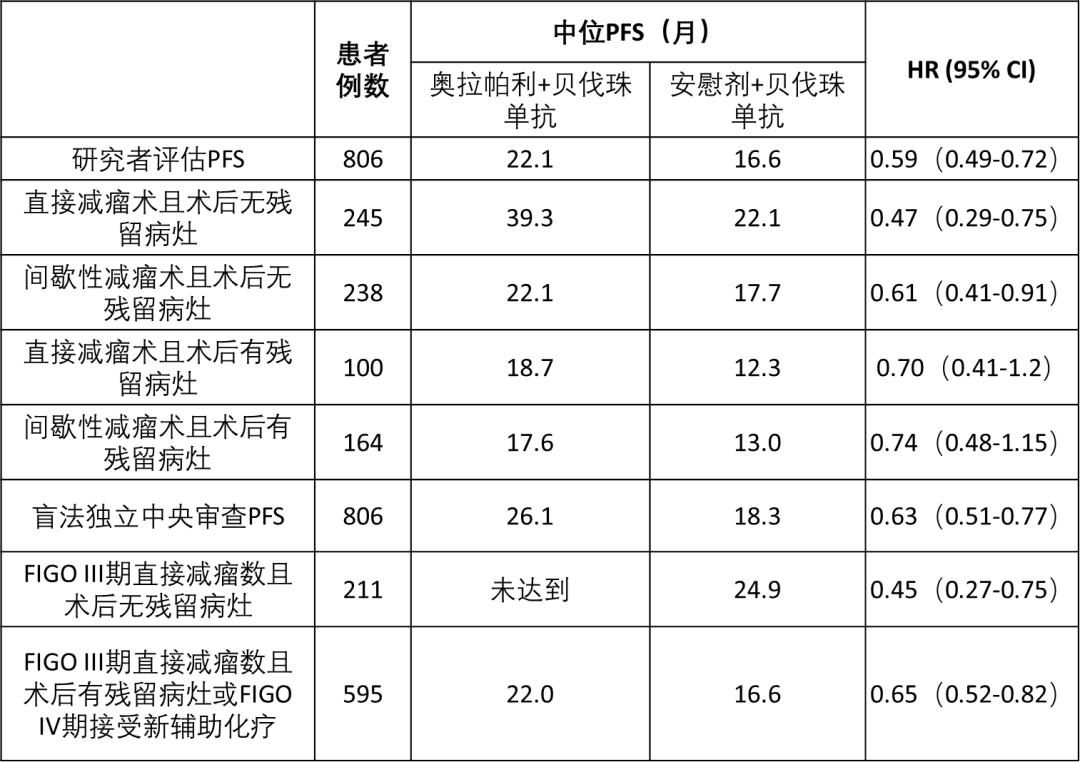
结论:在新诊断的晚期高级别浆液性卵巢癌患者中,无论手术时间或术后残留病灶状况如何,与单独使用贝伐珠单抗相比,使用奥拉帕利联合贝伐珠单抗进行一线维持治疗明显改善了预后。并且当手术实现满意减瘤时,特别是在接受直接减瘤术的患者中,PFS获益是最大的。
*目前奥拉帕利联合贝伐珠单抗治疗卵巢癌的适应症在中国尚未获批,目前奥拉帕利在中国获批的适应症为:携带胚系或体细胞BRCA 突变的晚期上皮性卵巢癌、输卵管癌或原发性腹膜癌初治成人患者在一线含铂化疗达到完全缓解或部分缓解后的维持治疗,铂敏感的复发性上皮性卵巢癌、输卵管癌或原发性腹膜癌成人患者在含铂化疗达到完全缓解或部分缓解后的维持治疗。本材料所提供的相关信息在任何情况下均不应作为治疗或使用建议,亦不用于推广目的。
2、【113 - Featured Poster Session】Patterns and adoption of BRCA testing in ovarian cancer in the real world: Observations from Flatiron Health
真实世界卵巢癌BRCA检测模式及其应用:Flatiron Health 的观察
目的:真实世界中有关卵巢癌(OC)患者BRCA检测的信息有限。鉴于可选治疗方案的改变以及关于进行胚系及体系测序检测的不明确性,我们试图确定美国普遍OC患者胚系(gBRCA)和体细胞(sBRCA)测试的现实趋势、检测时机和检测结果。
方法:我们选取2011年1月1日至2018年5月31日见确诊并接受了一线治疗的OC患者,这部分患者依托Flatiron Health HER衍生数据库进行至少一年的随访。此数据库是一个包含未识别的患者级结构化和非结构化数据,通过技术支持的抽象进行管理的美国全国性数据库。患者接受化疗线数可根据手术和化疗的日期通过算法得出,使用描述性统计学方法分析所有数据。
结果:在所有期别的1921名一线OC患者中,69%患者在随访中至少进行过1次BRCA检测。随访中发现,在所有接受检测的患者中,68%只进行了gBRCA检测,9%患者只进行了sBRCA检测,30%患者接受过多于1次检测。在2011年确诊的患者中,25%的患者在确诊后1年内接受了BRCA检测(gBRCA, 23%; sBRCA, 1%)。2018年所有BRCA、gBRCA和sBRCA检测的比例分别增加到69%、61%和20%,10%接受检测的患者检出BRCA1突变(BRCA1m),8%检出BRCA2突变(BRCA2m)。大部分BRCA1m和BRCA2m为gBRCAm。大多数患者在一线治疗前(10%)或在一线治疗期间(46%)都接受了检测,而在一线治疗后出现了“补充”检测现象。在随访期间接受二线治疗的1076名患者中,172名(16%)在二线治疗期间接受了BRCA检测;其中有100名二线患者(9%)是首次检测。在接受三线治疗的700名患者中,81名(12%)在三线治疗期间接受了BRCA检测,其中有46名患者(7%)是首次检测。
结论:近十年来,OC患者中的gRBCA和sBRCA检测都有所增加,有三分之二以上2018年确诊的患者在随后1年内进行了检测。然而,只有68%的人接受了BRCA测试,且只有21%的人接受了sBRCA测试,这意味着部分适合靶向治疗的患者错失了被筛选出来的机会,并且她们的家庭成员也失去了接受遗传咨询的机会。因此有必要进行进一步的研究,以了解BRCA检测的预测因素、最佳检测顺序以及检测结果对疾病进展、治疗选择和疗效的影响。
3、【LBA 25 - Scientific Plenary】Avelumab in combination with and/or following chemotherapy vs chemotherapy alone in patients with previously untreated epithelial ovarian cancer: Results from the phase 3 javelin ovarian 100 trial
阿维鲁单抗联合化疗并持续使用或化疗后使用阿维鲁单抗对比单纯化疗治疗初治上皮性卵巢癌:III期临床试验JAVELIN Ovarian 100研究结果。
目的:该随机、开放标签III期临床试验(JAVELIN Ovarian 100;NCT02718417)评估了阿维鲁单抗联合化疗并持续使用或化疗后使用阿维鲁单抗对比单纯化疗治疗初治上皮性卵巢癌(EOC)患者的疗效。
方法:对减瘤术后或适用新辅助化疗的III/IV期EOC患者进行1:1:1随机分组,分别接受:6个周期的化疗(卡铂AUC5/6静脉注射 Q3W;紫杉醇175mg/m2 Q3W或80mg/m2 QW(研究者可选))后阿维鲁单抗维持治疗(静脉注射10mg/kg Q2W,化疗→单抗组);化疗联合阿维鲁单抗(静脉注射10mg/kg Q3W,化疗+单抗→单抗组),然后阿维鲁单抗Q2W维持治疗;或化疗后观察(化疗→观察,对照组)。主要终点是独立盲法中心评估的PFS(RECISTv1.1)。
结果:共998例患者纳入随机分组。中期分析时(数据截止日期:2018年9月7日),中位随访时间为:化疗→单抗组,11.1个月(95% CI 10.3-12.2);化疗+单抗→单抗组,11.0个月(95% CI 10.5-11.9);化疗→观察组,10.2个月(95% CI 9.5-10.8)。在两个阿维鲁单抗组中,PFS与对照组相比均没有改善,超过了预先设定的无效界限,试验停止。两组对比对照组的HR值分别为化疗→单抗组的1.43(95% CI 1.051-1.946)和化疗+单抗→单抗组的1.14(95% CI 0.832-1.565)。化疗→单抗组的中位PFS为16.8个月(95% CI 13.5-NE),化疗+单抗→单抗组的中位PFS为18.1个月(95% CI 14.8-NE),化疗→观察组中位PFS未达到(95% CI 18.2–NE)。基于基线特征和生物标记物(PD-L1、CD8和BRCA)的分层分析并未发现两个阿维鲁单抗组中有显著获益的亚组人群。总生存率数据尚不成熟,未达到中值。三组的客观缓解率分别为:化疗→单抗组30.4%(95% CI 25.5-35.7),化疗+单抗→单抗组36.0%(95% CI 30.8-41.4),化疗→观察组30.4%(95% CI 25.6-35.7)。未见新的安全信号。在化疗→单抗组、化疗+单抗→单抗组和化疗→观察组中,分别有66.5%、70.8%和62.6%的患者出现了3级以上的治疗引起的不良反应。
结论:在初治EOC患者中使用检查点抑制剂的首个III期临床试验在两个阿维鲁单抗治疗组中均未达到改善PFS的主要终点。没有发现新的安全信号。为了进一步了解检查点抑制剂在该疗法中的应用,正在进行后续的转化分析。
4、【Scientific Plenary I—4】Phase II OVARIO study of niraparib + bevacizumab therapy in advanced ovarian cancer following front-line platinum-based chemotherapy with bevacizumab
Ⅱ期OVARIO研究:尼拉帕利联合贝伐单抗用于卵巢癌一线贝伐单抗联合含铂化疗后的维持治疗
目的:尼拉帕利提高了新诊断和复发性卵巢癌患者接受铂类化疗后,所有生物标志物确定的亚组的无进展生存期(PFS)。OVARIO (NCT03326193)是一项单臂研究,旨在评估晚期卵巢癌患者一线铂类化疗+贝伐珠单抗治疗后,接受尼拉帕利+贝伐珠单抗治疗的效果。
方法:所有新诊断为FIGO分期III期-IV期的卵巢癌患者,在一线铂类化疗+贝伐珠单抗后达到完全缓解或部分缓解(CR或PR)后均符合入组标准。接受新辅助化疗和早期减瘤术的患者均符合入组标准。所有患者在入组时都进行了组织同源重组缺陷检测(HRd或HRp)。贝伐珠单抗的剂量为15 mg/kg,每3周一次,自一线化疗其持续15个月。根据基线体重和血小板计数,在完成一线治疗后12周内开始尼拉帕利治疗,每日一次,每次300或200 mg,持续3年或直到进展性疾病(PD)或不可接受的毒性。主要终点是治疗开始后18个月的PFS。在所有患者开始治疗并进行2次检测后,在开始治疗后6个月时进行中期PFS分析。
结果:共105例患者纳入分析。中位年龄为60岁,中位体重68公斤。大多数患者接受新辅助化疗(63%)、III期(79%)、浆液性卵巢癌(95%)。49%的患者有高血压病史,47%的患者携带HRd,包括HRd-BRCA突变和HRd-BRCA野生型。78%患者的初始剂量为200mg。6个月的PFS比例为89.5%。≥3级的治疗相关不良反应包括血小板减少、贫血和高血压,同采用相同治疗方案的AVANOVA试验类似。
结论:尼拉帕利+贝伐珠单抗联合用药方案的安全性与两种药物作为单药疗法的已知副作用是一致的,而且这种组合似乎不会引起累积毒性。在一线铂类化疗+贝伐珠单抗的晚期卵巢癌患者中,治疗组(尼拉帕利+贝伐珠单抗)中位PFS尚未达到。
5、【32-seminal abstracts】Time to first subsequent therapy (TFST) and progression-free survival 2 (PFS2) from the phase 3 randomized, double-blind PRIMA/ENGOT-OV26/GOG-3012 study in patients with newly diagnosed ovarian cancer
初诊卵巢癌患者的III期、随机、双盲临床试验PRIMA/ENGOT-OV26/GOG-3012:TFST和PFS2的分析
目的:尼拉帕利能延长一线含铂化疗晚期卵巢癌缓解后的无进展生存期。此次报道PRIMA/ENGOT-OV26/GOG-3012的次要研究终点。
方法:此随机、双盲、安慰剂对照、III期临床试验纳入733例一线含铂化疗达CR/PR的初诊晚期卵巢癌,原发性腹膜癌或输卵管癌患者。患者服用尼拉帕利或安慰剂每天1次直至36个月或疾病进展。主要研究终点是PFS,由BICR评估。次要研究终点是TFST(time to first subsequent therapy,随机分组至第一次疾病进展后采取治疗的时间)、PFS2(progression-free survival 2,随机分组至第2次出现疾病进展的时间)。
结果:总体人群中,尼拉帕利组中位TFST比安慰剂组长6.6个月(HR=0.65, 95% CI 0.52–0.80, P=0.0001; 表格1)。在同源重组缺陷肿瘤患者中,尼拉帕利组中位TFST未达到,安慰剂组为13.7个月(HR=0.46, 95% CI 0.33–0.64, P<0.0001)。在具有同源重组功能的肿瘤患者中,尼拉帕利组中位TFST比安慰剂组的患者长3.7个月(HR=0.64, 95% CI 0.46–0.90,P<0.0105)。PFS2数据显示点估计值HR < 1,如表1所示(总体数据成熟度20%)
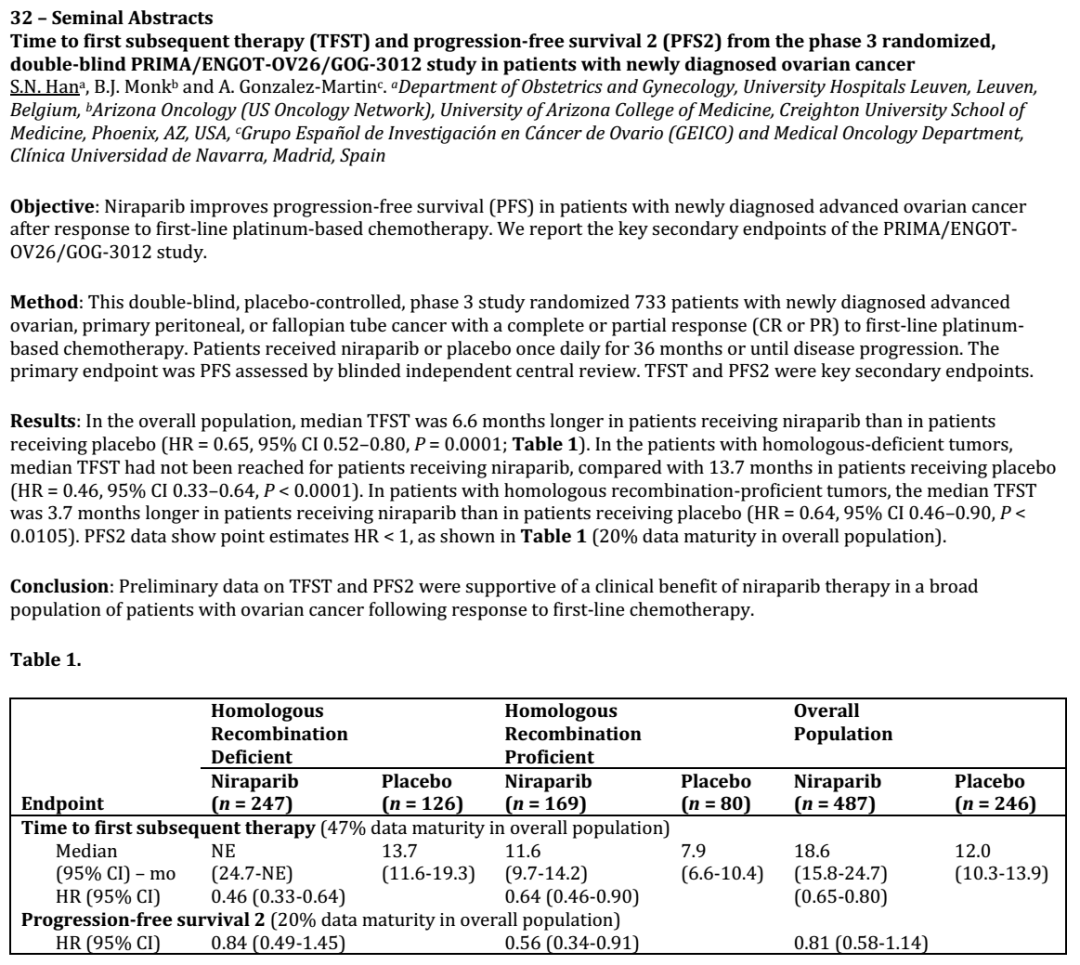
结论:TFST和PFS2的初步数据支持卵巢癌患者一线化疗缓解后使用尼拉帕利有临床获益。
仅供医疗卫生专业人士使用和参考。本资料可能含有未经许可的产品或适应证信息,阿斯利康不建议您将产品用于未经许可的适应证。如果需要处方,请参考产品最新详细处方资料。





 京公网安备 11010502033352号
京公网安备 11010502033352号