编者按:本期“诺华NET之声”,精选了4篇2019年5月发表的神经内分泌肿瘤(NET)领域研究文献。其中3篇文献主要探讨NET患者预后评估,包括阑尾神经内分泌肿瘤淋巴结侵犯危险因素、胰腺神经内分泌肿瘤根治术后复发新标志物及基于免疫微环境特征的胃肠胰神经内分泌肿瘤预后评估模型。另有1项来自郑州大学第一附属医院的单中心大样本研究,回顾性分析了该中心NET患者的流行病学、临床特征、治疗和预后情况,同时邀请到郑州大学第一附属医院肿瘤内科宋丽杰教授,对该研究成果进行深入评述。敬请关注!

1. 中国547例神经内分泌肿瘤患者的临床分析:一项单中心研究
IF:3.202
背景:神经内分泌肿瘤(NETs)较为罕见,关于该疾病流行病学和临床特征的公开发表的数据相对缺乏。因此,该研究旨在调查NETs患者的流行病学、临床特征、治疗和预后。
方法:回顾性分析了547例病理诊断为NETs的患者的临床特征,包括年龄、性别、原发和转移部位、症状、病理、治疗和预后等。
结果:547例患者年龄范围较广(9-87岁),男女比例为1:1.1。肿瘤原发部位方面:413例位于消化系统,74例位于肺部,15例位于纵隔,8例原发部位不明,37例位于其他部位。在413例消化系统NETs患者中,胰腺、直肠和胃是最常见的原发部位。84例患者在首次确诊时已发生血行转移,其中,肝、骨、肺是最常见的转移部位。82例患者在首次确诊时已发生淋巴结转移。手术和化疗是临床常用的治疗手段。统计分析显示,年龄<50岁、女性、低级别肿瘤、无远处转移、肠道NET和行手术治疗的患者预后较好。
结论:小肠NETs在其他国家非常普遍,但在中国属罕见。中国常见的NETs原发部位为胰腺、直肠和胃。虽然目前可以通过诸如手术、靶向治疗和生长抑素类似物的治疗方法来改善预后,但尚无统一的治疗方法。
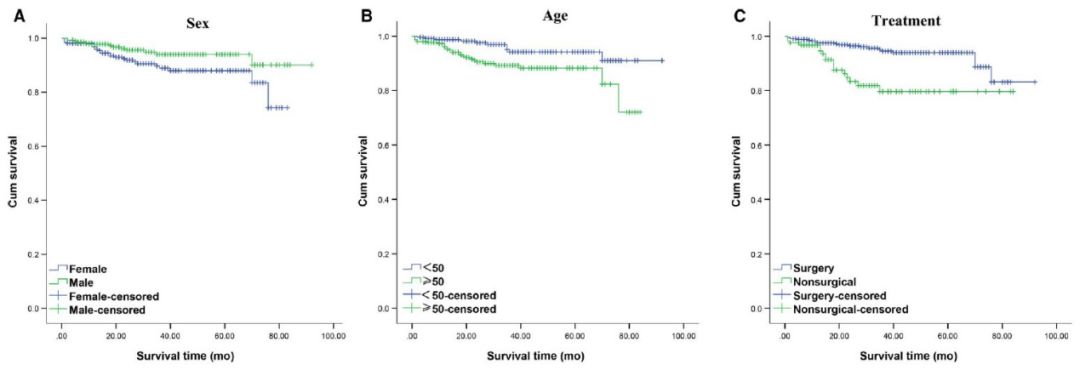
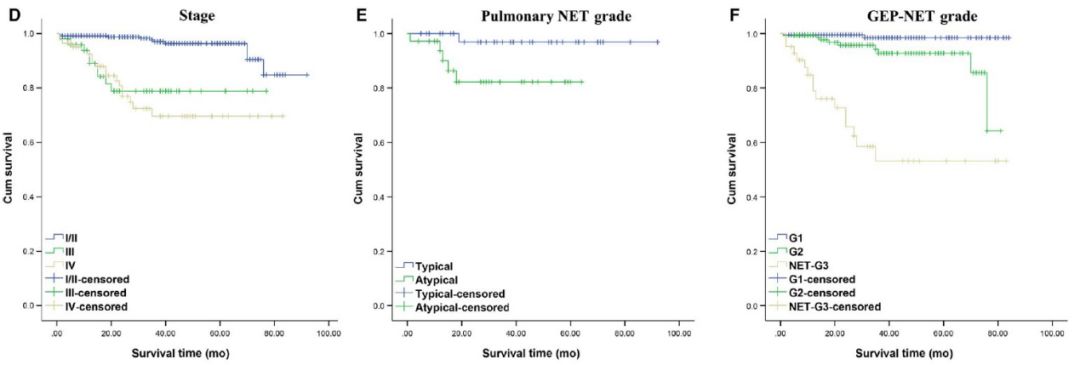
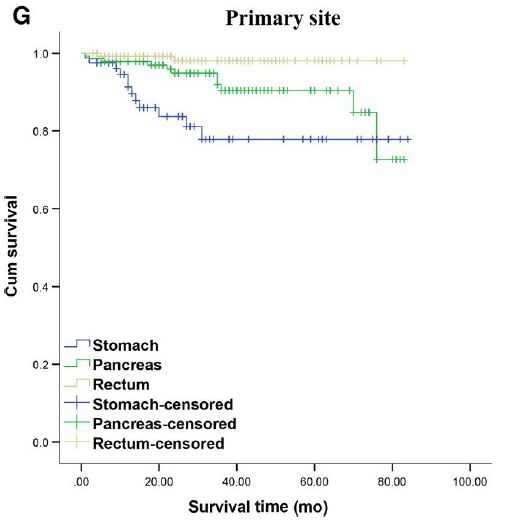
图1 生存分析
A.不同性别患者总生存期
B. 不同年龄患者总生存期
C.是否接受手术的患者总生存期
D.不同肿瘤分期患者总生存期
E.肺类癌及不典型类癌患者总生存期
F.不同分级GEP-NETs患者总生存期
G.胃、胰腺、直肠NET患者总生存期

2019年5月6日, 由郑州大学第一附属医院肿瘤科牵头的神经内分泌肿瘤MDT团队合作完成了一篇名为《Clinical analysis of 547 patients with neuroendocrine tumors in a Chinese population: A single‐center study》的论著在线发表于Cancer Medicine杂志。文章回顾性分析了该院2011年1月至2018年4月经病理确诊为神经内分泌肿瘤的547例患者临床资料,并进一步探讨其流行病学特征、临床特点,分析其治疗手段及预后。
神经内分泌肿瘤是一种罕见病,发病率较低,但1973-2012年美国NETs的年龄校正发病率由1.09/10万上升为6.98/10万,增幅达540%,上升趋势明显。有关NENs的报道,美国、挪威、日本、韩国等均有相关数据库的建立,数据较为完善。但我国大陆目前仅有几家单中心报道、尤其是NETs病例数较少、各中心的诊治侧重有差异且多无生存分析。
国外流行病学资料显示,欧美NETs多发于小肠、直肠、胰腺[1.2]。国内小肠发病罕见,多发生于胰腺、直肠、胃。这可能与人种、地域及饮食差异有关。依荷芭丽·迟等[3]分析了中国医学科学院肿瘤医院252例NENs(不包括肺小细胞癌),排在前4位的是肺(29.4%)、直肠(23.0%)、胃(10.7%)、阑尾(3.2%)。邱旭东等[4]分析了卫生部中日友好医院903例NENs(不包括肺小细胞癌),排在前4位的是胃(22.9%)、直肠(22.3%)、胰腺(20.5%)、肺、胸腺或纵膈(9.6%)。我院547例NETs患者数据,GEP-NETs患者392例(71.7%)、肺74例(13.5%)、GEP-NETs中排在前4位的依次是胰腺141例(25.8%)、直肠136例(24.9%)、胃81例(14.8%)、十二指肠19例(3.5%)。由此可见国内不同中心常见的发病部位存在差异。原发部位不同,疾病预后也不同。我们随访分析发现直肠原发患者的1、3、5年生存率均高于胰腺原发患者,胰腺原发患者均高于胃原发患者,差异有统计学意义。本中心直肠NETs中G1的占比明显高于胰腺和胃,而胃NETs中NET-G3的占比明显高于直肠和胰腺。而G1的预后明显优于G2及NET-G3。直肠NETs的预后优于胰腺NETs及胃NETs,可能与分级占比有关。总体来说,NETs的预后较好,关于NETs的治疗,相关的循证医学证据仍然较少。手术是NETs首选治疗方式,非手术治疗主要包括SSAs,靶向治疗,化学疗法和PRRT等。
由于NETs的罕见性和异质性,目前临床诊断和治疗还存在很多问题,多学科会诊方式是此类患者的最优诊疗模式。为此我院在河南省率先成立了神经内分泌肿瘤MDT团队并开设神经内分泌肿瘤专科门诊,为NETs的规范诊疗奠定了基础。期待未来能积累更多数据,为我国神经内分泌肿瘤的规范化诊治添砖加瓦。
参考文献(上下滑动可查看)
[1] Dasari A, Shen C, Halperin D, et al. Trends in the Incidence, Prevalence, and Survival Outcomes in Patients With Neuroendocrine Tumors in the United States[J]. JAMA Oncol,2017,3(10):1335-1342.
[2] Boyar Cetinkaya R, Aagnes B, Thiis-Evensen E, et al. Trends in Incidence of Neuroendocrine Neoplasms in Norway: A Report of 16,075 Cases from 1993 through 2010.[J]. Neuroendocrinology,2017,104(1):1-10.
[3] 依荷芭丽·迟,姜文昌,杜丰等. 神经内分泌瘤252例临床分析[J]. 中华肿瘤杂志,2013,35(1):67-70.
[4] 邱旭东,刘猛,刘青等. 903例神经内分泌肿瘤发病部位与病理特征分析[J]. 中华胃肠外科杂志,2017,20(9):993-996.
2. 现有的阑尾神经内分泌肿瘤危险因素能准确预测局部淋巴结侵犯吗?来自大型病例的系列研究结果
IF:5.024
背景:阑尾神经内分泌肿瘤(ANEN)是罕见的实体肿瘤,通常表现为惰性疾病进程。单纯的阑尾切除术通常可以治愈,存在局部转移风险的患者在阑尾切除术基础上还推荐完成右半结肠切除术(RHC)。现行“指南”对于具有局部转移风险患者的评价标准仍存争议,这些标准可能导致过度治疗,而这也是年轻患者群体的顾虑之一。
目的:评估当前标准对于更准确识别高风险患者的预后价值。
方法:该研究是一项回顾性研究,共纳入10年内向三级转诊中心寻求建议或治疗的263例ANEN患者。其中,72例患者根据国际指南推荐的标准接受了RHC。对每一例RHC手术标本进行评估,以确定其是否与淋巴结侵袭(LNI)相关。
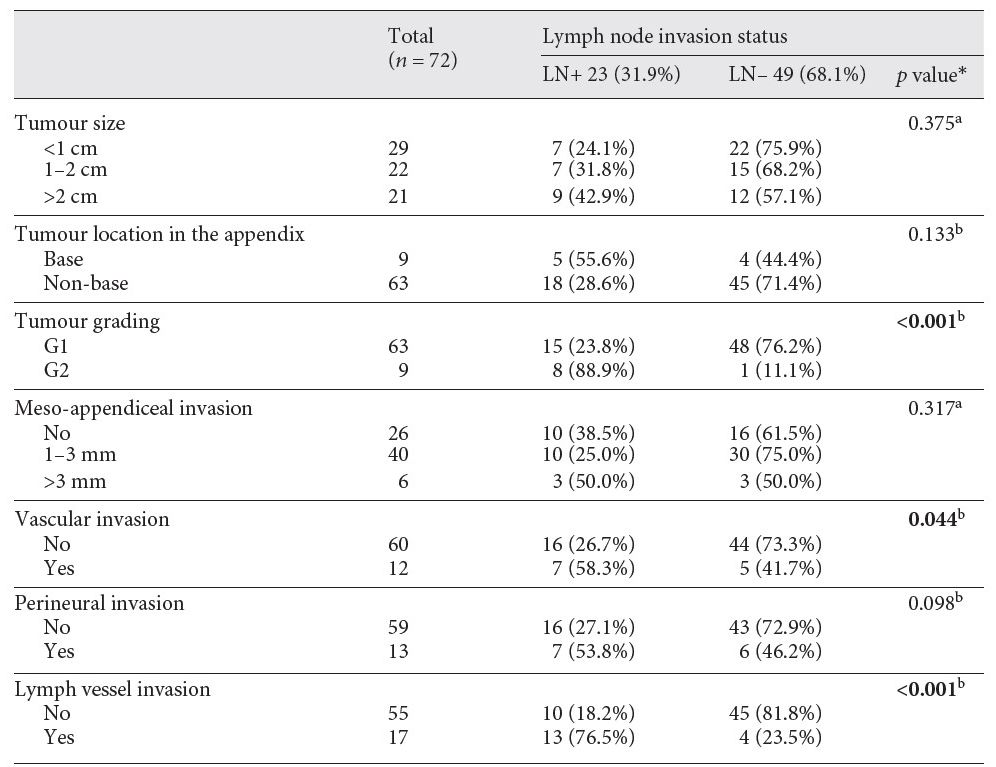
结果:肿瘤分级(P<0.001)、血管(P=0.044)和淋巴管侵犯(P<0.001)均为LNI的独立危险因素;而肿瘤大小(P=0.375)和阑尾系膜(MAI)受侵犯 (P=0.317)与LNI的相关性无统计学意义。然而,在LNI阳性亚组中,深度MAI和肿瘤大小>2 cm具有相关性。阑尾基底部受侵犯的位置与LNI具有潜在相关性,但仍无统计学意义(P=0.133)。
结论:较高的肿瘤分级和淋巴血管侵犯应被视为最重要的预后风险因素,而该研究队列中未发现肿瘤大小的显著相关性。尚需要大样本的国际多中心研究,以充分验证这些结果。
表1 阑尾神经内分泌肿瘤疾病特征与淋巴结侵犯的相关性
3. CLEC3A、MMP7和LCN2作为G1和G2级胰腺神经内分泌肿瘤根除术后复发预测的新标记物
IF:3.202
背景:据报道,胰腺神经内分泌肿瘤(PNETs)的术后复发率为13.5-30%,然而,缺乏能够有效预测复发的生物标志物仍然是限制早期预测复发的难题。
目的:探索预测PNETs复发的新型生物标志物。
方法:研究者收集了其所在中心的1998年至2015年根治性切除的所有局限性G1/G2级 PNETs的原发肿瘤冰冻样本,从中提取出RNA进行RNA测序(RNA-Seq)。随后分析匹配队列中伴和不伴复发(≥3年)的肿瘤样本的差异表达基因(DEGs)。并对鉴定出的DEGs进行基因本体分析。此外,该研究通过免疫染色评估候选基因的蛋白表达水平能否作为复发预测因子。比较伴和不伴复发肿瘤基因转录水平后,研究发现了166 个DEGs。在这些肿瘤中,高度显著性上调和下调的基因主要与细胞外组织和细胞粘附相关。随后,研究分析前三位上调基因,C型凝集素结构域家族3成员A(CLEC3A)、基质金属蛋白酶-7(MMP7)和脂质运载蛋白2(LCN2)在免疫组化中的改变,并比较它们在复发和非复发肿瘤中的水平差异。
结果:CLEC3A(P=0.028)、MMP7(P=0.003)和LCN2(P=0.040)阳性表达患者的复发率显著高于阴性表达患者。
结论:与磷脂酰肌醇-3-激酶/Akt途径相关的CLEC3A、MMP7和LCN2可作为预测PNETs术后复发新的潜在标志物。
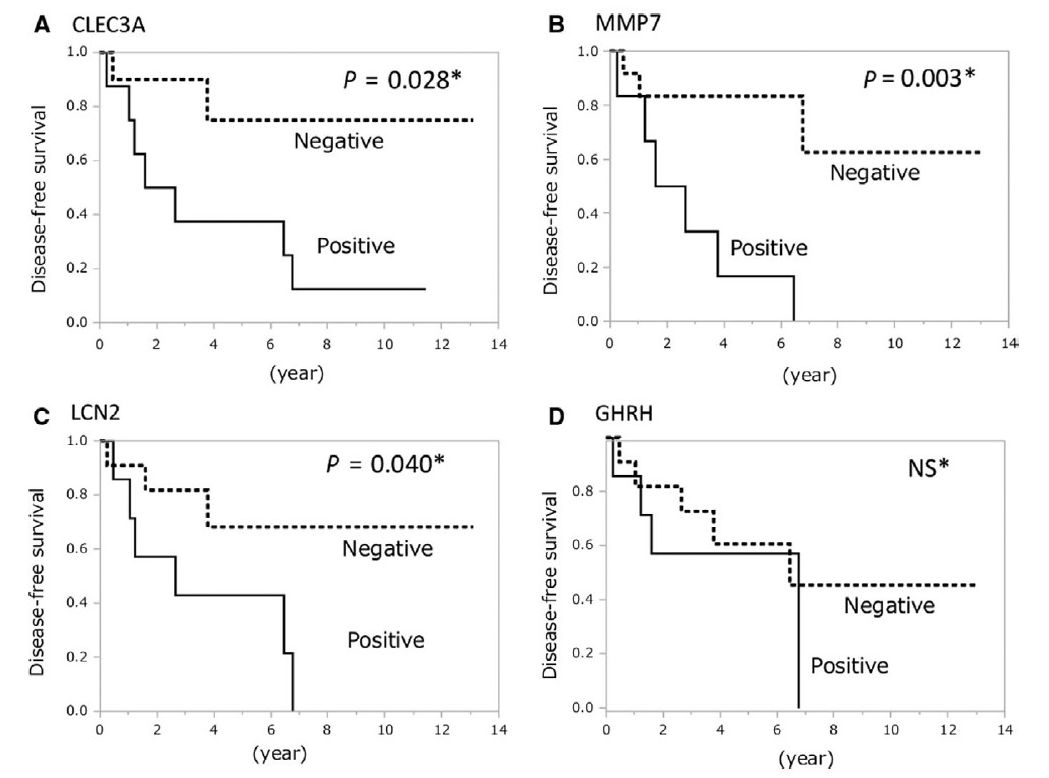
图2 患者术后无病生存期
log-rank检验提示,CLEC3A(A),MMP7(B)和LCN2(C)表达情况与患者无病生存期显著相关。
4. 微环境和肿瘤炎症特征可提高胃-肠-胰神经内分泌肿瘤(GEP-NENs)预后评估的准确性
背景:微环境相关的免疫和炎症标志物,与Ki-67指数和形态学指标相结合,可提高胃肠胰神经内分泌肿瘤(GEP-NENs)的预后评估准确性。
目的:评价GEP-NENs的微环境和肿瘤炎症特征(MoTIFs)对预后评估的价值。
方法:对350例患者的福尔马林固定、石蜡包埋的组织切片使用免疫组化方法(IHC)检测其免疫、炎症、血管生成、增殖、NEN-及成纤维细胞相关的标志物。314例患者数据用于计算总生存期(OS)和无病生存期(DFS)的MoTIFs预后指数(PIs)。使用Cox模型评估预后指数和其他变量,并生成预测5年OS和DFS的列线图。36例患者用于预后指数和列线图预后分层的外部验证。
结果: G1/G2级和G3级GEP-NENs存在免疫炎症标志物的表型差异。根据HLA、CD3、CD8和PD-1/PD-L1 IHC表达,可将G3级分成两个亚组,分别具有高或低获得性免疫相关特征。用于OS评估的MoTIFs PIs基于COX-2 Tumor(T)> 4,PD-1 Stromal(S)> 0,CD8S <1和HLA-IS <1,该指数与较差的OS相关[风险比(HR)2.50;95%置信区间(CI),2.12-2.96;P <0.0001]。用于DFS评估的MoTIFs PI基于COX-2T> 4,PD-1S> 4,HLA-IS <1,HLA-IT <2,HLA-DRS <6 (HR 1.77; 95%CI,1.58-1.99; P<0.0001)。在分化良好的GEP-NENs中,该研究构建了两个列线图,分别用于OS评估【包括形态学(HR 4.83; 95%CI,2.30-10.15;P<0.001)和Ki-67指数(HR 11.32;95%CI,5.28-24.24;P<0.001)】及DFS评估【包括形态学(PI=0:HR 10.23;95%CI,5.67-18.47;PI=5:HR 2.87;95%CI,1.21-6.81;P<0.001)和MoTIFs PI(HR 6.21;95%CI,2.52-13.31;P<0.001)】。
结论:G1/G2级向G3级的转变与免疫炎症谱的变化有关;MoTIFs与肿瘤形态学和Ki-67指数相结合,可提高GEP-NENs5年DFS预测准确性。分化差的G3级肿瘤中的一个亚组的免疫环境与获得性免疫的激活一致,这提示,该亚组肿瘤可能对针对免疫检查点的免疫疗法产生应答。
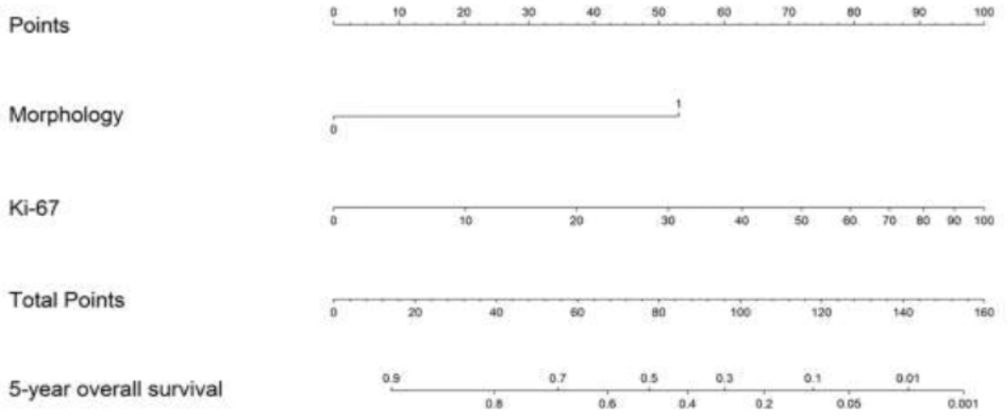
图3 预测5年OS的列线图
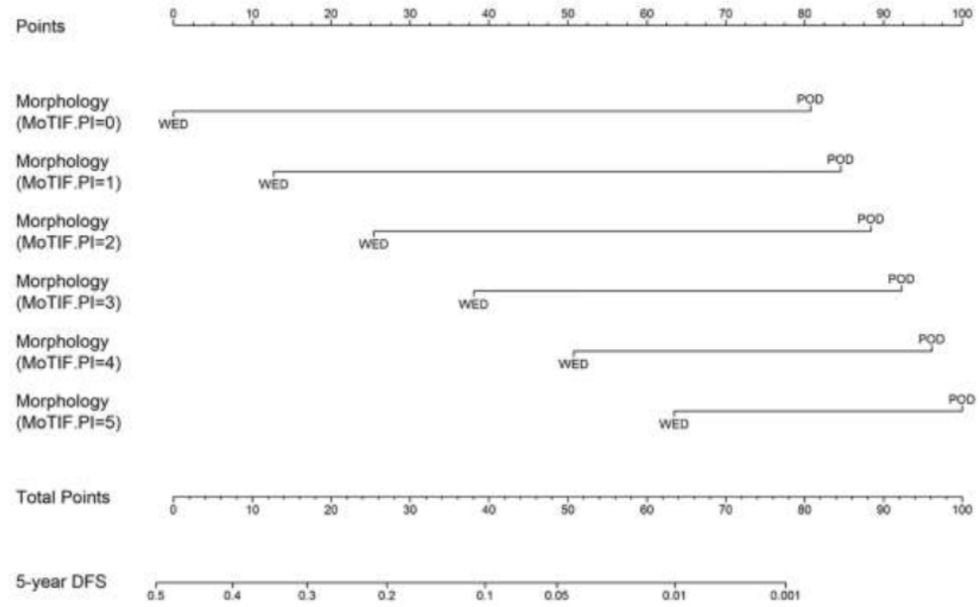
图4 预测5年DFS的列线图
Net1907270
副主任医师,副教授,硕士研究生导师
肿瘤学医学博士,MD ANDERSON 高级访问学者
CSCO神经内分泌肿瘤专家委员会委员
中国医促会 CNETS专业委员会青年委员
中国医促会CNETS专业委员会河南省地方学组组长
中国医师协会外科医师分会MDT专委会青年委员
河南省抗癌协会NETS专业委员会副主任委员
河南省抗癌协会NETS专业委员会青委会主任委员
河南省老年学会肿瘤专业青委会副主任委员
河南省抗癌协会肿瘤临床化疗专业委员会委员
河南省肿瘤临床精准诊断与治疗专业委员会常委





 京公网安备 11010502033352号
京公网安备 11010502033352号