编者按:中国肿瘤免疫及靶向治疗高峰论坛暨首届高博医学论坛将于4月20-21日在北京举行,秉持“精准,整合,创新”的理念,围绕肿瘤的精准诊断,免疫及靶向治疗,基因治疗,造血干细胞移植等前沿话题,开创免疫及靶向研究领域先河,邀请海内外500余位专家参与盛会。嵌合抗原受体(CAR)T细胞(CAR-T)治疗在临床试验中获得成功案例,治疗疾病包括B细胞急性淋巴细胞白血病(ALL)或B细胞淋巴瘤,堪称“革命性的抗癌疗法”,为很多对于标准治疗无效患者提供了潜在的治愈希望。基于 JULIET研究的数据,Tisagenlecleucel(也称为KYMIRAH)成为第一个在美国获得批准的CAR-T疗法; 2018年5月,美国食品和药物管理局批准tisagenlecleucel用于治疗2线以上的成人DLBCL患者。此次会议也设置了细胞免疫治疗的探讨环节,并且邀请到细胞免疫治疗研究领域的顶级医疗中心之一-宾夕法尼亚大学专家分享经验。应《肿瘤瞭望》邀请,负责FDA批准的第一个CAR-T细胞疗法产品研究的核心专家Prof. Joseph Melenhorst接受了采访,分享细胞免疫治疗面临的挑战与机遇。

《肿瘤瞭望》:细胞免疫治疗的转化医学面临的最大挑战是什么? Q1:What are the biggest challenges in translational medicine of cellular immunotherapy?
Prof. Joseph Melenhorst:CAR-T免疫疗法是一种高效的过继细胞疗法的形式,在治疗B细胞急性淋巴细胞白血病或大B细胞淋巴瘤患者所获得的高缓解率已经证明了这一点,并且已经获得FDA批准。目前细胞免疫治疗面临最大的挑战就是准确定义成功癌症治疗的关键特征,包括肿瘤靶抗原。 我们已成功使用针对CD19抗原的CAR,成功实现靶向B细胞恶性肿瘤的治疗,但已发现治疗ALL中疾病复发与抗原丢失相关; 抗原调节方面 – 体现在恶性B细胞表达的CD19和/或CD22抗原丢失或下调 - 使肿瘤逃逸成为一种对CAR-T细胞治疗失败的机制,这也可能是非B细胞恶性肿瘤(包括实体瘤)的问题。CD22目前正在美国,中国和其他地方进行评估,以治疗此类患者。尽管针对抗原下调的问题,采取组合多抗原靶向的发展策略,确保对每种抗原的有效反应是必不可少的。然而,开发多功能性,多目标的构建体并非易事,且高度依赖于临床前研究来识别具有兼容生物活性同时靶向抗原的共建体,目前来自美国NIH癌症研究中心儿科肿瘤科的Qin, H和同事报道了靶向CD19和CD22的双嵌合抗原受体的临床前研究(Mol. Ther. Oncolyt. 11, 127–137,2018) 。非霍奇金淋巴瘤(NHL)和慢性淋巴细胞白血病(CLL)存在不同的挑战,而目前针对NHL靶抗原的定义尚不明确,但我们最近发表的研究发现CLL已经可以有很好的细胞免疫治疗的标记物。
Identifying key features that define a successful cancer therapy, including the target antigen. We have been successful at targeting B cell malignancies using a CD19 targeting CAR, but have seen relapses in ALL that are associated with antigen loss; CD22 is currently being evaluated in the US, China and elsewhere to treat such patients. NHL and CLL present with different challenges which remain poorly defined for NHL, but well-characterized for CLL as we recently published.
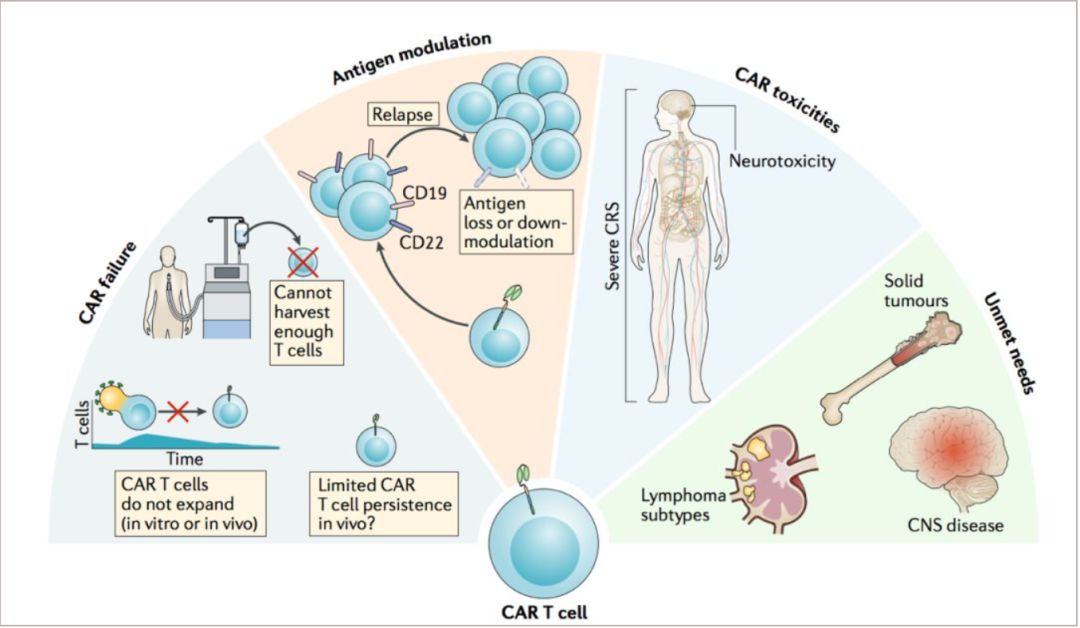 图 1 | CAR-T细胞治疗后无法获得持久缓解的因素和局限性
图 1 | CAR-T细胞治疗后无法获得持久缓解的因素和局限性
《肿瘤瞭望》:哪些基础研究目前在临床应用中更有前景?
Q2:Which basic research is currently more promising in clinical applications?
Prof. Joseph Melenhorst:基础研究近年来发展迅猛,对临床最可能有深远影响的就是进一步开发基因组编辑工具,追求翻译和编码更加精准,允许以最小的脱靶概率精准编辑所需区域。 该领域的进展非常迅速,很可能会在未来3-5年内改变我们为免疫治疗所制备细胞的方式。
The identification of genome editing tools, translational and basic really, that allow the precise editing of the desired region with minimal off-target editing. Progress in this field is swift and likely to change how we generate cells for immunogene therapy in the coming 3-5 years quite dramatically.
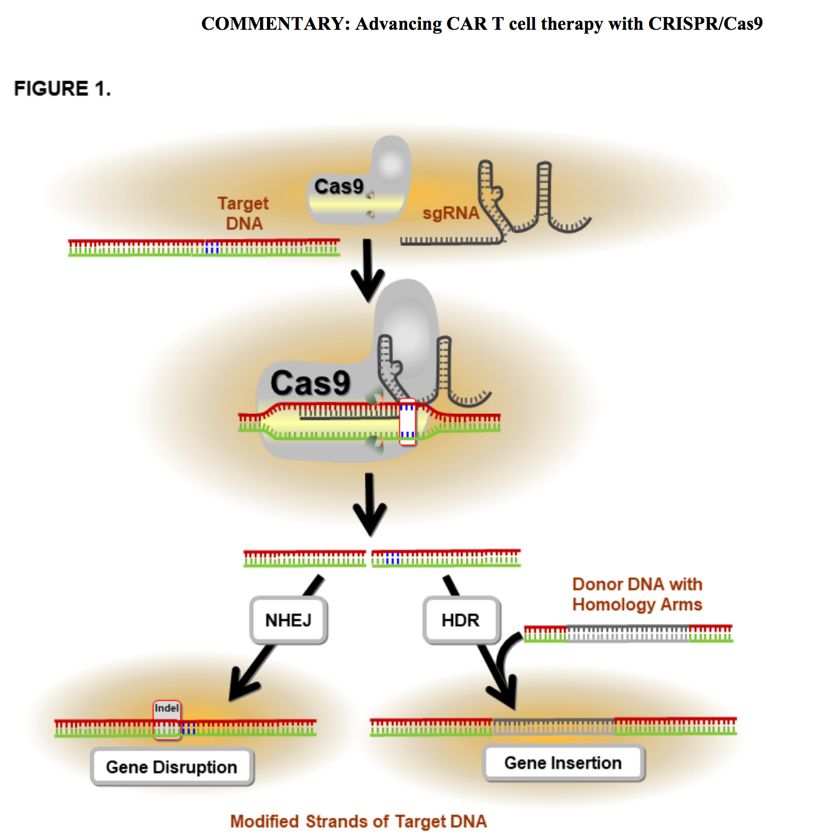 图2: CRISPR/Cas9-based genome editing in the Era of CAR T cell immunotherapy.
图2: CRISPR/Cas9-based genome editing in the Era of CAR T cell immunotherapy.
《肿瘤瞭望》:您能介绍一下在临床实践中应用CAR-T的挑战吗? 有什么优点和缺点?
Q3:Can you introduce the challenges of applying CAR-T in clinical practice? Any advantages and disadvantages?
Prof. Joseph Melenhorst:上面已经概述了其中一些挑战。例如妨碍持久缓解及继续CAR-T细胞治疗的因素包括:难以获得足够的T细胞,有限的CAR-T细胞在体外及体内的扩增和/或CAR-T在体内的不持续性及免疫逃逸等机制。 此外,CAR-T功效和毒性的不可预测性仍然困扰着这个领域,这些是CAR-T治疗的不利方面。目前许多研究机构正致力于发展克服这些障碍的研发策略,以优化这一独特的治疗手段并扩展其治疗的适应症。考虑到很少有其他疗法已经表现出如此深度的,持久的疗效,而科学正在迅速发展,我相信通过我们的不懈努力一定能够在这些领域取得进展以应对这些问题。
Yes, some of those challenges have been outlined in the above. Also, the unpredictability of efficacy and toxicity still plague the field, which are disadvantages, but considering that few other therapies have demonstrated such deep, durable responses and that the science is moving at a very fast pace I am confident that we will make the necessary progress to tackle such problems.

Prof.Joseph Melenhorst
宾夕法尼亚大学医学院病理学和检验医学系教授
在国立卫生研究院(NIH)完成博士后研究后,他于2012年被Carl June博士招募到宾夕法尼亚大学,首先担任临床细胞和疫苗生产设施副主任,后来又任命为产品开发与相关科学总监。 在此期间,他负责FDA批准的第一个CAR-T细胞疗法产品研究:Kymriah。 Melenhorst博士为CAR制造过程的发展做出了重大贡献,并对CAR-T细胞疗法的免疫生物学进行了深入的机制方面研究,该论文发表在高影响力期刊上,如Nature,Nature Medicine,Cancer Discovery,Science Translational 医学和新英格兰医学杂志。
Melenhorst博士的研究旨在通过生物标志物,阐述机制和产品开发研究来了解和改善过继细胞免疫疗法的功效,实现安全性和产品一致性。
参考文献:
1.Shah NN,FryTJ. Mechanisms of resistance to CAR T cell therapy.Nat Rev ClinOncol.2019Mar 5.
2.Salas-MckeeJ,KongW et.al CRISPR/Cas9-based genome editing in the Era of CAR T cell immunotherapy. Hum Vaccin Immunother. 2019 Feb 8.





 京公网安备 11010502033352号
京公网安备 11010502033352号