2015年NCCN年会上,来自UCSF Helen Diller家族综合癌症中心的Margaret A. Tempero, MD做了题为“胰腺癌多学科管理(Multidisciplinary Management of Pancreatic Cancer)”的报告,简要内容如下:
2015年NCCN年会上,来自UCSF Helen Diller家族综合癌症中心的Margaret A. Tempero, MD做了题为“胰腺癌多学科管理(Multidisciplinary Management of Pancreatic Cancer)”的报告,简要内容如下:
胰腺导管腺癌的进展一直非常缓慢
1.治疗困难
● 80%的患者被诊断为晚期无法切除的疾病
● 80%的切除术后加辅助治疗的患者复发
● “治愈”率仅为7%
● 转移未经治疗患者的中位生存期仅为3个月
2.侵袭性高
● 没有早期症状
● 非常早期的侵袭和转移
● 化疗耐药(庇护?)
● 细胞因子介导的症状使人身体虚弱
管理
●可切除/交界性可切除
●局部晚期
●转移性
团队
放射科医生
消化科医生
外科医生
医学肿瘤医生
放射肿瘤科医生
病理医生
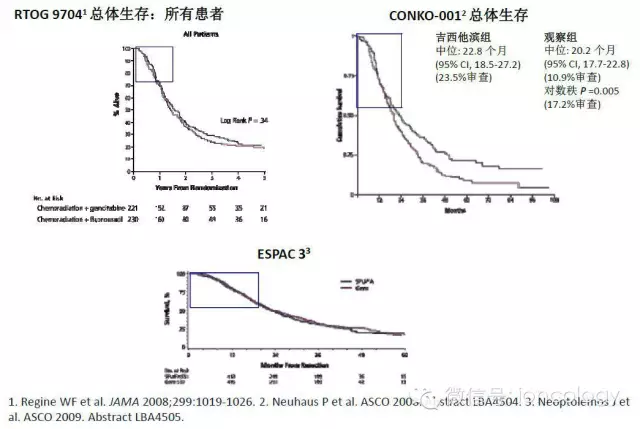
胰腺癌辅助治疗25年的发展历程回顾
相关试验
|
研究
|
干预
|
最佳中位OS
|
|
GITSG
19851
|
观察 vs 放疗后加
5FUa
|
21.0
|
|
EORTC
1999, 20082,3
|
观察 vs 放化疗
|
17.1
|
|
ESPAC 1
20044
|
观察 vs 5FU/La
vs放化疗vs 放化疗+5FU/L
|
20.1
|
|
RTOG 9704
20085
|
吉西他滨+放化疗
vs c.i. 5FU+放化疗
|
20.5
|
|
CONKO 001
20136
|
观察 vs 吉西他滨a
|
22.8
|
|
ESPAC 3
20107
|
吉西他滨 vs 5FU/L
|
23.6
|
a 较优治疗组。
1. Kalser MH, Ellenberg SS. Arch Surg. 1985;120:899‐903. 2. Klinkenbijl JH et al. Ann Surg. 1999;230:776‐782. 3. Smeenk HG et al. Ann Surg. 2007;246:734‐740. 4. Neoptolemos JP et al. N Engl J Med. 2004;350:1200‐1210. 5. Regine WF et al. JAMA. 2008;299:1019‐1026. 6. Oettle H et al. JAMA. 2013;310:1473‐1481. 7. Neoptolemos J et al. JAMA. 2010;304:1073‐1081.
上表中辅助治疗试验(RTOG 9704、CONKO 001、ESPAC 3):总体生存期图示
ESPAC-1试验(2004年):胰腺癌切除后放化疗和化疗的随机试验
加放化疗 vs. 不加放化疗
加放化疗(145例)中位生存期:15.9个月(95% CI, 13.7~19.9);
不加放化疗(144例)中位生存期:17.9个月(95% CI, 14.8~23.6)。
加化疗 vs. 不加化疗
加化疗(147例)中位生存期:20.1个月(95% CI, 16.5~22.7);
不加化疗(142例)中位生存期:15.5个月(95% CI, 13.0~17.7)。
观察 vs. 只加放化疗vs. 只加化疗vs. 放化疗加化疗
观察(69例)中位生存期:16.9个月(95% CI, 12.3~24.8);
只加放化疗(73例)中位生存期:13.9个月(95% CI, 12.2~17.3);
只加化疗(75例)中位生存期:21.6个月(95% CI, 13.5~27.3);
放化疗加化疗(72例)中位生存期:19.9个月(95% CI, 14.2~22.5);
要点1
● 25%‐30%患者早期死亡
● 辅助治疗有效
● 吉西他滨和最佳给药剂量的5‐氟尿嘧啶/亚叶酸有类似的效果
● 放射疗法的作用还不清楚
● 请记住,这些试验关注的是经过挑选的患者!25%的患者没有接受辅助治疗
要点2
1. 辅助治疗的时机未表现出与总体生存优势有关
2. 术前治疗所需时间可使侵袭性疾病有机会发生,不能从手术获益的患者可接受替代治疗
3. 未行手术切除的患者如果接受过全身治疗似乎表现更好
4. 术前FOLFIRINOX的使用在增加
A021101试验:新辅助化疗和放化疗后手术切除与交界性可切除胰腺癌辅助化疗的初步研究(局部晚期胰腺癌单组II期临床试验)
FOLFIRINOX×2个月→重新分期→卡培他滨XRT 50.4 Gy→重新分期→手术→重新分期→吉西他滨×2个月
锋线化疗+放疗 vs. 化疗
Gem中位OS:9.2个月
Gem+RT中位OS:11.1个月
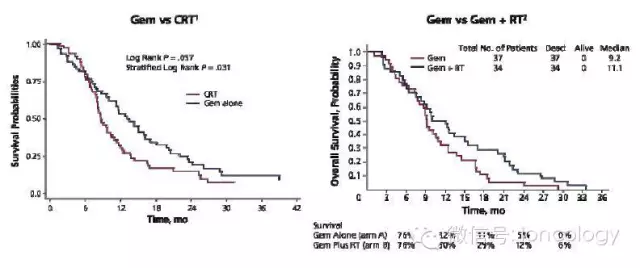
LAP07研究:评估卡培他滨/XRT和厄洛替尼的作用
吉西他滨 vs. 吉西他滨+厄洛替尼
吉西他滨中位OS:13.6个月
吉西他滨+厄洛替尼中位OS:11.9个月
化疗(CT) vs. 放化疗(CRT)
化疗(CT)中位OS:16.4个月
放化疗(CRT)中位OS:15.2个月
Prodige 4 - ACCORD 11试验设计(转移性胰腺癌)
Folfirinox vs. 吉西他滨
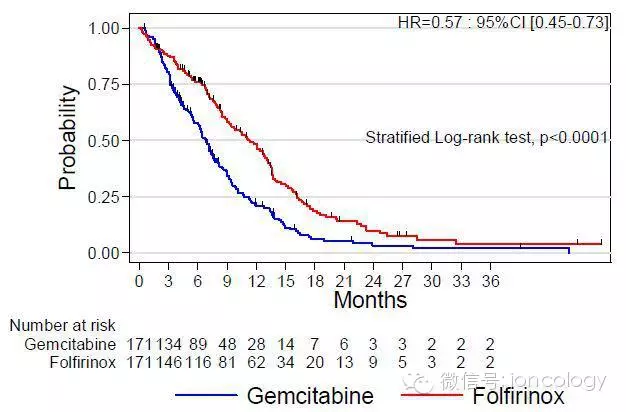
为使FOLFIRINOX耐受:
● 略去静推5FU
● 减少剂量
● 使用化疗间歇
MPACT研究设计
●N = 842
●IV期
●既往没有治疗的转移性疾病
●KPS ≥70
●可测量病灶
●总胆红素≤ULN
主要终点:– OS
次要终点:– 独立审核(RECIST)的PFS和ORR
安全性和耐受性–NCI CTCAE v3.0
|
白蛋白结合型紫杉醇
125 mg/m2 IV qw 3/4 weeks
+吉西他滨
1000 mg/m2 IV qw 3/4 weeks
|
Vs.
|
吉西他滨
1000 mg/m2 IV qw for 7/8 weeks
then qw 3/4 weeks
|
白蛋白结合型紫杉醇+吉西他滨 vs. 吉西他滨
Alb-P + Gem的中位OS:8.5个月(95% CI:7.89–9.53)
Gem的中位OS:6.7个月(95% CI:6.01–7.23)
其他方案
1. 吉西他滨+卡培他滨
2. 吉西他滨+顺铂
3. GTX
4. 吉西他滨+厄洛替尼
5. 其他选择
NCI智库(2012年10月)
●寻找一种方式来对RAS用药
●专注于微环境
基质靶点
●血管生成(如果基质消耗有效,未来可能会更为重要)
●激活的星形细胞(Hh途径?)
●基质性流体压力(透明质酸)
●TGF-B
●T regs
●促癌巨噬细胞、粒系细胞、B细胞
JAK-STAT信号抑制作为一种新型的癌症治疗方法
●Janus激酶(JAKs)是一个激酶家族,包括JAK1、JAK2、JAK3和TYK2
●JAKs通过激活STAT转录因子介导细胞因子信号
●Ruxolitinib是JAK1和JAK2的抑制剂,可阻止由许多促炎细胞因子介导的信号传导
●在骨髓纤维化患者的临床研究中,Ruxolitinib减少了炎性细胞因子的水平并改善了症状和总生存期
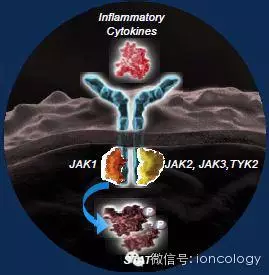
胰腺导管腺癌(PDAC)的全身性炎症
●全身性炎症是晚期恶性肿瘤患者中常见的表现,并与不良预后相关
●炎症信号传导可能介导癌症的代谢特征,如:恶病质、肌肉损失和不良的体能状态
●C-反应蛋白(CRP)具有良好的特征和敏感性,是全身性炎症容易测量的标志物
●CRP升高在许多人类癌症(包括胰腺癌)中具有负面预后意义
研究设计
患者入选标准
●病理证实转移性胰腺导管腺癌(PDAC)
●卡氏评分PS ≥60
●吉西他滨治疗失败
终点
●主要终点:OS
●次要终点:临床获益(疼痛的组合、卡氏评分PS、镇痛药的使用、体重),1 ORR(RECIST),证实的缓解(4周),PFS,生活质量,安全性
|
Ruxolitinib
15 mg BID, days 1–21
卡培他滨
1000 mg/m2 BID, days 1–14
|
Vs.
|
安慰剂
BID, days 1–21
卡培他滨
1000 mg/m2 BID, days 1–14
|
ITT中位OS:
Ruxolitinib+卡培他滨(n=64):136.5日
安慰剂+卡培他滨(n=63):129.5日
CRP > 13 mg/L患者中位OS:
Ruxolitinib+卡培他滨(n=31):83.0日
安慰剂+卡培他滨(n=29):55.0日
考虑到癌症的遗传异质性,适应性免疫可能在控制疾病进展中具有最大的价值
胰腺癌免疫为基础的临床试验
● Plerixafor(AMD3100)
–免疫刺激剂、拮抗剂CXCR4
–在小鼠模型中增加了T细胞反应,协同抗‐PDL1,耗竭癌细胞
● 疫苗为基础的方法
–全肿瘤细胞(GVAX)—辅助、新辅助
–李斯特菌为基础的疫苗(CRS-207)
– Algenpantucel‐L—佐剂
– VEGFR‐DNA(VXM01)—沙门氏菌
– PANVAC(CEA、MUC‐1)
● 抗体
– CD40, CTLA‐4 (ipilumumab), anti–PD‐1 (nivolumab) /PD‐L1
● 工程化T细胞(CAR)
–间皮素、CEA
● 小分子
‐ Ibrutinib
总结
●现在我们有稳定病情的化疗
●正在大力进行针对RAS的研究
●正在探究基质相关的靶点,特别是免疫靶点
●局部晚期疾病的治疗最好加入锋线化疗
●评委会将放化疗的的地位放在更为有效的化疗之后





 京公网安备 11010502033352号
京公网安备 11010502033352号