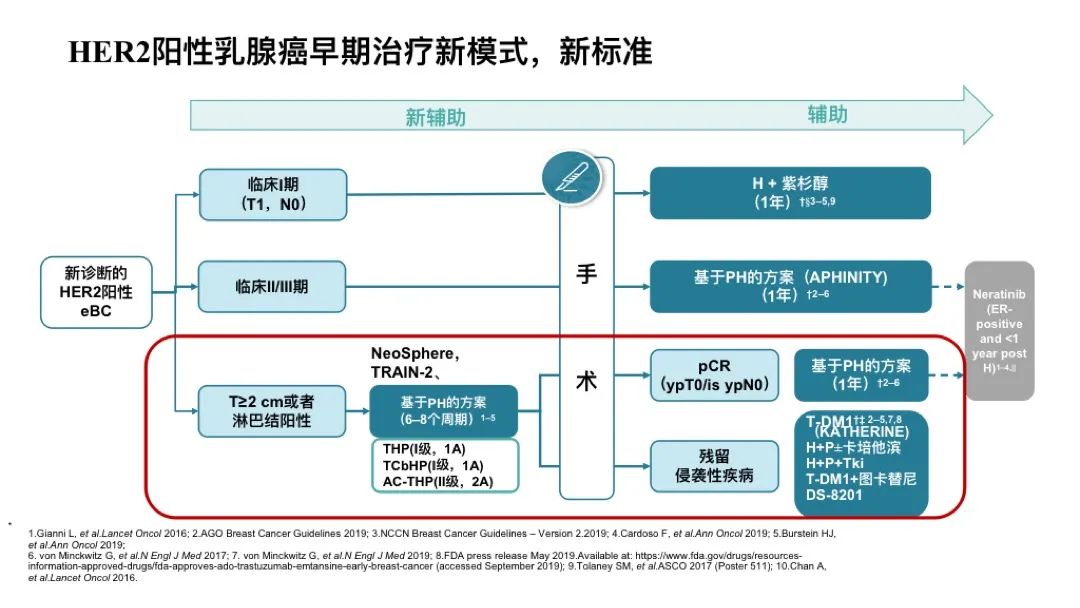
对于新诊断的HER2阳性早期乳腺癌,临床1期(T1,N0)可以直接进行手术治疗,术后辅以H+紫杉或TC4H方案。临床Ⅱ、Ⅲ期没有进行新辅的患者,基于APHINITY研究行HP双靶辅助治疗1年。Neratinib可作为标准治疗后的延长强化手段,在曲妥珠单抗/帕妥珠单抗(新)辅助治疗和/或T-DM1治疗后,今年St.gallen大会63.46%专家支持ER+且非常高危患者应该接受奈拉替尼辅助治疗,如淋巴结≥4个转移患者。
对于≥2cm或LN+,基于NeoSphere,TRAIN-2等研究更多采用新辅助治疗方案,PH双靶6~8周期,如TCbHP,AC-THP,THP等。术后达pCR患者,临床实践更多予以PH-PH一年方案,对于低危低负荷双靶新辅后pCR患者,今年St.gallen专家共识支持,单靶也是一个可选方案。对于non-pCR患者,T-DM1是标准治疗(KATHERINE),但其非针对曲帕双靶头对头的研究,对于一些新辅治疗反应良好的,也可考虑继续HP强化或是HP+卡培他滨,但缺乏强有力循证医学证据支持。T-DM1只能降低50%复发风险,并不能解决所有问题。T-DM1+图卡替尼(COMPASS-HER rd),H+P+TKI,DS-8201 (DESTINY-Breast05)谁会是未来的治疗新选择?
对于HER2+新辅助方案,我们进行了许多探索,包括单抗联合TKI:曲妥珠单抗联合吡咯替尼,NA-PHER2:NAHT同步CDK4/6i同步抗HER2治疗,IMpassion050:曲妥+帕妥+阿替利珠单抗HER2阳性eBC新辅助Ⅲ期研究,比较豪华的Neopeaks研究(TCbHP+T-DM1+P)等。
TCbHP方案是目前HER2+乳腺癌新辅助优化方案,EC-THP也是一个可选的方案,THP作为不能耐受铂类或双化疗方案的患者,更多作为临床研究的设计 ,PREDIX研究中6个周期THP,pCR率仅为47%,低于TCbHP的56%,且尚无生存数据。4或6个周期THP之后,是否必须序贯蒽环目前尚无数据证实。
新辅助治疗的探索已经从“最大可耐受治疗”逐步到“最小有效治疗”,COMPASS研究中4个周期THP之后,根据pCR、non-pCR进行升级降阶探索,又或PHERGAIN研究中2个周期无化疗双靶方案,根据PET Scan判断其治疗敏感性指导后续治疗决策。
今年ASCO报道的WSG-ADAPT系列研究引起关注,ADAPT是一项前瞻性、多中心、随机对照非盲的Ⅱ/Ⅲ期伞形系列研究,利用新辅助平台通过早期标记物如ki67表达变化、影像学、功能影像学又或基因检测等来指导辅助治疗的降阶,探索出不同分子分型中可以精准降阶梯的亚人群,实现个体化治疗的同时最大限度地避免不必要的治疗相关毒性和无效治疗。

WSG-ADAPT HR-/HER2+研究将HR-,HER2+患者分成两组,一组接受12周的H+P双靶治疗,另外一组接受PH联合紫杉醇单药,进行三周的诱导后行穿刺活检,再完成剩余治疗。研究结果显示,双靶治疗联合紫杉醇组pCR率达到了90.5%,远高于单用双靶治疗组(34.4%)。进一步论证双靶联合化疗是目前的标准方案。今年ASCO报道了生物标志物及生存结果。研究首次观察到P+H降阶新辅助治疗具有pCR和生存获益,不需进一步使用化疗,此研究样本量少,仍需进一步证实。此研究更大价值在于探索未来一些特定优势人群可能免于化疗方案(如:HER2 3+,non-basal-like , 早期应答高敏感型,有免疫印记等特定RNA表达特征)。
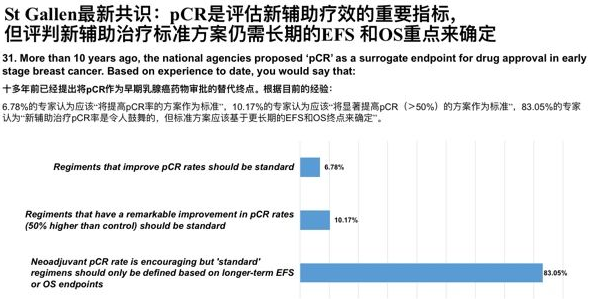
pCR是评估新辅助疗效的重要指标,十多年前已经提出将pCR作为早期乳腺癌药物审批的替代终点。今年St.Gallen最新共识,根据目前的经验:83.05%的专家认为“新辅助治疗pCR率是令人鼓舞的,但标准方案应该基于更长期的EFS和OS终点来确定”,既有pCR的提高又有生存的获益才是最有价值的新辅助方案。
总之,HER2+早期乳腺癌系统治疗由辅助-新辅助-新辅助后强化治疗格局的转变,要探索“最佳”个体化新辅治疗方案,需筛选出敏感/不敏感人群进行精准治疗,特别强调需多学科团队的合作,标准、规范治疗的实施。并基于疗效引导的新辅助模式,重视早期疗效动态评估指导策略(更换,局部,精准治疗),NBRST Trial及I-SPY研究,是否在新辅助治疗前利用分子数据(Mammaprint和Blueprint)改进亚组新辅助治疗的选择。对于HER2阳性辅助治疗:依据复发风险分层分类,对于腋结阴性患者是否使用双靶需综合其他危险因素(如肿瘤大、ER阴性、组织学3级、Ki67高表达、脉管癌栓、年轻等),是否可以建立数学模型精准筛选术后辅助双靶治疗的获益人群,又或是进一步探究双靶更敏感更大获益的HER2阳性患者内在亚型人群?
“HER2低表达”近来得到越来越多的关注,HER2低表达肿瘤具有独特的生物学特征,治疗效果和生存结局有所不同 。DS-8201及RC48-ADC在晚期HER2低表达研究得到了初步数据,目前国外正开展DS-8201在低表达人群新辅助中探索:评估DS-8201联合阿那曲唑或单药用于新辅助治疗HR+/HER2低表达乳腺癌的安全性和有效性,研究去年10月开始启动,预计2025年完成,期待研究结果。
我们也期待更多新的抗HER2药物的出现,带来更多治疗选择,患者更大获益。
HR+/HER2-患者如何决策辅助治疗?1.先进行风险分层;2.决定是否需要化疗;3.内分泌方案。
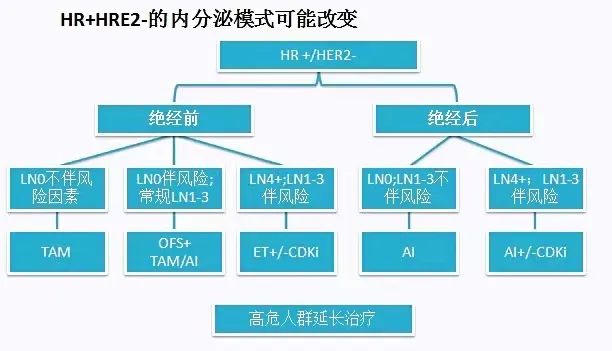
如何预判ER+近期/远期复发风险是治疗决策的关键和前提,包括临床病理参数,如近期(0-5年)/远期(5-10年),LN,T,G,Age等参数。可通过St Gallen风险评估分层、基于STEPP分析的风险分数、CTS5预测模型、网络预测工具(Adjuvant Online!)等进行风险分析。近些年对这部分人群的治疗加入了多基因判断预后的策略,如近期预测:21基因,70基因,BCI,PAM50,EPClin。远期预测:BCI,PAM50,EPClin。
2020 SABCS报道,Trans-aTTom研究-BCI指数联合ER、PR、AR及Ki67预测内分泌延长,不论临床风险如何,高BCI(H/I)内分泌治疗反应性患者接受来曲唑治疗的5年获益明显优于2.5年,低BCI(H/I)的患者接受来曲唑治疗5年 vs 2.5年的获益无统计学意义。与风险评估相比,BCI(H/I)预测内分泌治疗获益是一种更实用的方法。2019ASCO报道,远期复发风险评估—CTS5(clinical treatment score post 5 years),不论是否接受化疗,CTS5在未经筛选的女性患者队列中(包括绝经前女性)都具有预测价值,复发风险中高危患者可从延长内分泌治疗中获益。今年ASCO报道NSABP B-42试验中,70基因MammaPrint(MP)可用于预测延长来曲唑治疗的获益。
对于HR+/HER2-这部分人群的化疗决策,近些年最大进展应该就是用多基因组判断患者的预后,使得其中低风险的人群免除化疗的可能。WSG-ADAPT HR+/HER2-是个内分泌对比化疗的研究,中高危患者中根据RS评分结合新辅助内分泌Ki67情况来调整治疗策略,对于RS 12-25中Ki67<10%的人群,预后与RS 0-11相似,可以安全免除化疗。
对于内分泌治疗方案,低危低复发风险患者,5年他莫昔芬已经足够,高危高复发风险的患者有两种强化方式:延长和强化。在年轻Luminal A型患者中,尽管生物学指标良好,但是年轻使得复发风险增加,小于35岁的5年BCFI为83.6%,辅助他莫昔芬可能不够 ,非常年轻的患者考虑OFS,OFS目前更多数据支持维持5年治疗。CDK4/6抑制剂靶向治疗从晚期逐步走到辅助、新辅(见下图)。
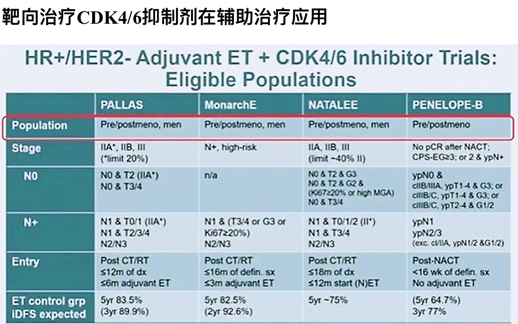
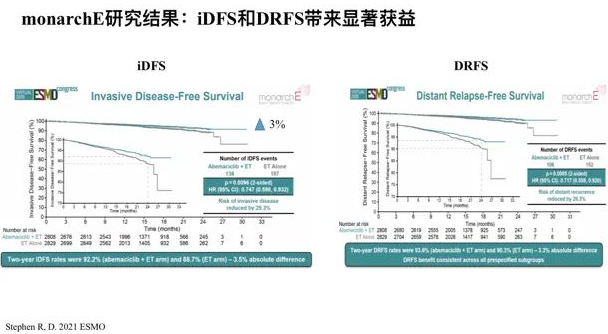
monarchE研究结果显示:对于高危患者,iDFS和DRFS带来显著获益。是否加用CDK4/6抑制剂尚需时间和更多数据,期待能对我们后续临床实践有指导意义。
对于新辅助治疗:NeoMONARCH研究新辅助阿那曲唑对比Abemaciclib或者两者联合。联合组和CDK4/6抑制剂组对于Ki67的改变较单药AI更显著。FELINE研究新辅助Ribociclib+来曲唑对比安慰剂+来曲唑,对细胞阻止的指数更明显改善。但是这些指标的改善能否转化成患者后续的获益,还有待进一步随访。
HR+乳腺癌进入了内分泌治疗“+”的时代,对于HR+HER2-的人群,我们路在何方?
1、应根据临床病理特征、结合复发风险评分(包括基因检测)及治疗的反应性(敏感性)来决定内分泌治疗的决策。
2、临床因素与多基因检测的博弈和共存。
3、 Abemaciclib可能改变HR+/HER2-乳腺癌辅助治疗模式,进一步探索获益人群及生物标志物。
4、早期乳腺癌内分泌耐药的问题(通路?早期发现或预测耐药处理?)
福建省立医院肿瘤外科主任医师
福建省立医院肿瘤外科行政副主任
福建省医学会乳腺病学分会副主任委员
中国抗癌协会乳腺癌专业委员会委员
CSCO乳腺癌专家委员会委员
中国医师协会肿瘤医师分会乳腺癌学组委员
长江学术带乳腺联盟副主任委员
海峡两岸医药卫生交流协会肿瘤防治专家委员会常务委员
《Gland Surgery》期刊编委





 京公网安备 11010502033352号
京公网安备 11010502033352号