患者60岁女性,10余年冠心病史、3年咳喘史、2年高血压史。主诉右乳肿物1月,查体右乳两个相邻肿瘤,总范围5.9X3cm,超声显示大小分别为3.0X2.4X1.6cm和2.3X2.2X1.8cm。腋窝可触及融合淋巴结,超声显示右腋下多发转移性淋巴结,最大2.2X1.7cm。ECT未见骨转移。穿刺病理为右乳浸润性癌,腋下低分化癌,ER60%,PR25%,HER-2 3+,KI-67 40%, P53 30%。
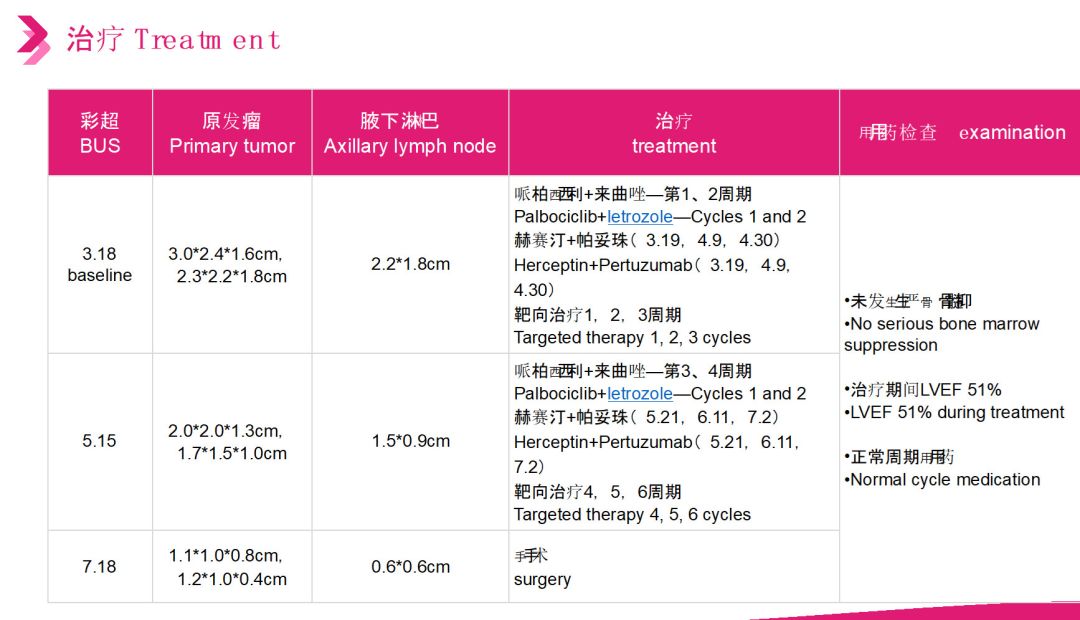
患者所合并心肺疾病为化疗相对禁忌,故新辅助治疗选择内分泌治疗联合靶向治疗,每2个月评估一次疗效,4周期后原发瘤及腋下淋巴缩小,行右乳癌仿根治术,患者pCR,区域淋巴结阴性。
讨论问题

讨论问题一:廖宁教授:对于该患者, 新辅助治疗阶段是采用内分泌治疗、靶向治疗还是二者联合?
周永昌教授:我们去年发表的 CDK 4/6 抑制剂联合内分泌进行新辅助治疗的研究显示,对激素受体阳性伴有HER-2阳性的患者可取得超过 80%的反应率。所以针对该三阳性患者,从治疗结果来看其所采用内分泌联合靶向治疗的治疗方向是正确且值得深入探索的。
Prof. Michael Douek :基于患者50岁、锁骨上方和颈部淋巴结的疑似受累、以及患者未行除腋窝淋巴结以外的穿刺活检的现状,假定该患者为淋巴结受累的非转移性乳腺癌,并在新辅助化疗后行改良的根治性乳房切除术和腋窝淋巴结清扫。但目前对50岁以上患者的新辅助内分泌治疗尚无指导性和相关的证据进行支持,其新辅助治疗未必可带来足够的生存获益,所以我认为可以直接行乳房切除术和前哨淋巴结活检,而无需采用新辅助治疗。
Prof. Seigo Nakamura:在临床实践中,对此患者的药物治疗不一定可以带来稳定的缓解,所以应尽早进行手术。而且考虑到患者心脏的问题,不建议患者使用靶向治疗,所以建议该患者仅采用内分泌治疗。
讨论问题二:廖宁教授:对于三阳性、高龄的乳腺癌患者,新辅助内分泌治疗时是否需要联合抗HER-2治疗?
Prof. Omar Z. Youssef对 Prof. Douek的观点表示赞成,可以根据患者肿瘤的大小行乳房切除术以给患者带来最大的获益。虽然内分泌联合靶向治疗给患者带来了很好的缓解,但并未豁免手术。而具体是否联合抗HER-2治疗则可根据不同中心进行个体化决定,联合与否都可行。Prof. Mien-Chie Hung与Prof. Tony Ng同样认为是否联合抗HER-2治疗需要个体化决定,此类三阳性乳腺癌患者有多种药物可以选择,如Prof. Nancy提到的PI3K抑制剂、伦敦的 Steven-Johnson提到的 TKI抑制剂等。问题的关键是在于HER-2的靶向治疗,从机理上看内分泌治疗联合抗HER-2治疗是可行的,抗HER-2的ADC药物也可作为一种选择。现下Daiichi Sankyo和AZ公司正在合作开发一种具备旁观者效应新型抗HER-2抗体偶联药物(ADC)DS-8201,不仅可以杀死HER-2阳性肿瘤细胞,也可以杀死肿瘤细胞周围HER-2正常表达的肿瘤细胞。所以在治疗过程中需要考虑循环生物标志物,从患者的cfDNA到现有的药物与相应的基因突变精准匹配,以最大限度的优化患者的系统治疗。
Prof. Nacy E. Anderson和顾林教授分别结中美流行病特点展开讨论,美国三阳性乳腺癌并不常见,临床实践中新辅助治疗多会联合抗HER-2靶向治疗;中国指南则以化疗或内分泌治疗为主。该患者乳房切除术后达到了pCR的结果十分理想,也为将来靶向治疗联合内分泌治疗的选择和化疗的豁免提供了思路,向精准治疗的目标又迈进了一步。
徐莹莹教授:病例二,HER-2+晚期乳腺癌一例
患者50岁女性,左乳术后7月余,发现肝占位1周入院。既往左乳改良根治术术后病理显示患者浸润性导管癌Ⅲ级, 肿块大小4*2.5*2cm, 左腋窝淋巴结7/18枚,pT2N2M0 IIIA期 ;IHC显示 ER - 、PR-、 CerbB-2(+++)、 Ki67(35%),HER-2扩增型。术后EC-THP方案,曲妥珠单抗帕妥珠单抗辅助治疗6个月,并行左侧胸壁内 、外切线野+锁骨上下野放疗25次,总剂量50Gy,依然发生了肝转移。
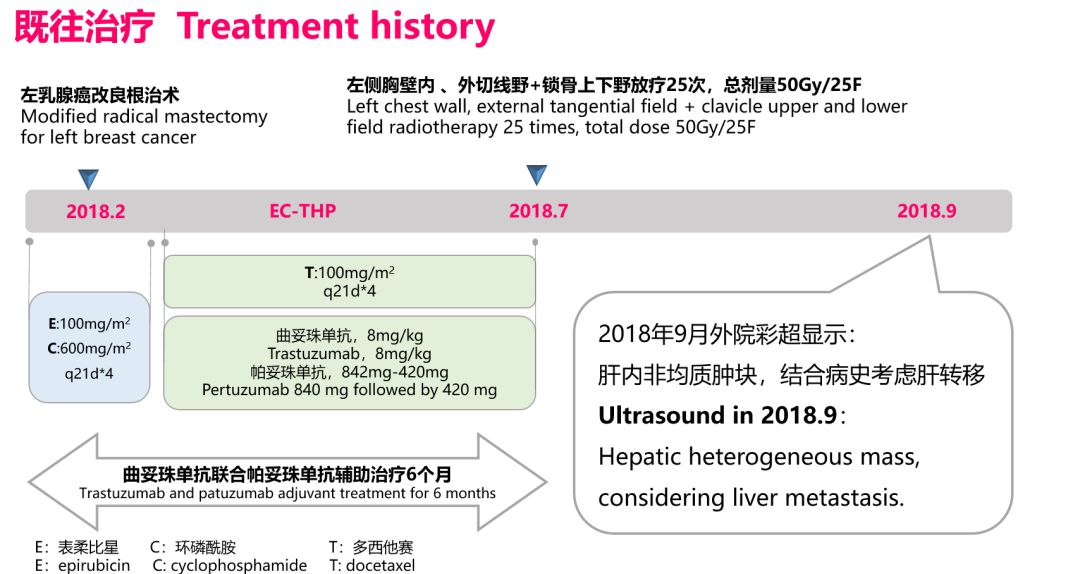
查体显示患者右乳及胸颈部正常;肝脏MRI显示右后叶内1.4cm*2.0cm结节,边界欠清,增强扫描程环形强化,考虑肝转移;介入穿刺显示为低分化癌,IHC显示ER- 、PR-、 CerbB-2(+++) 、KI-67 45%,确诊为乳腺癌肝转移。患者为辅助治疗12个月内的转移,应属于曲妥珠单抗、帕妥珠单抗耐药复发,根据徐兵河教授在17年SABCS公布的吡咯替尼联合卡培他滨优于拉帕替尼的研究,采用吡咯替尼联合卡培他滨方案解救治疗,2周期后CR,随访至今患者PFS已达到9个月,未见转移现象。

 讨论问题:廖宁教授:“曲妥珠单抗联合帕妥珠单抗”耐药后,晚期HER-2阳性乳腺癌的治疗选择手术选择吡咯替尼+化疗、拉帕替尼+化疗还是T-DM1?
讨论问题:廖宁教授:“曲妥珠单抗联合帕妥珠单抗”耐药后,晚期HER-2阳性乳腺癌的治疗选择手术选择吡咯替尼+化疗、拉帕替尼+化疗还是T-DM1?

10位专家进行投票,1位专家选择吡咯替尼+化疗,9位专家选择了T-DM1,此外 Prof. Michael Douek认为可以选择手术方式。
Prof. Michael Douek从外科医生的角度进行分析,认为该患者可采用肝定向治疗,这将意味着并不是所有的局部转移患者都要用药物处理,仅使用手术或射频消融即可到达治疗目的。周永昌教授也认为手术时机非常重要,射频消融的兴起使肝转移手术更为简单,甚至无需开刀。但由于循证医学证据的欠缺,相应的寡转移患者是否行手术,是先选择手术还是先选择药物治疗仍是值得商榷的。但在此情况下,Prof. Michael Douek对多数医生对此类患者更倾向于药物治疗表示担忧,以T-DM1为例,KATHERINE研究入组的1486例患者在初次化疗后分别给予T-DM1和曲妥珠单抗,但其中有约26%的患者无法手术,并且该研究未带来总体生存获益。所以面对一个新的治疗方法时,应该认真考虑患者的需求和必要性,在总体生存得到呈现时再选择用药。
有研究显示使用可逆的HER-2抑制如剂拉帕替尼,会因HER-2的表达而导致癌细胞增殖,所以Prof. Tony Ng认为不可逆的抑制剂如劳拉替尼可能更有优势。Prof. Davidson也比较了拉帕替尼和T-DM1的选取,鉴于美国尚无吡咯替尼,所以更倾向使用T-DM1。另外 ,PANACEA研究也进一步提出了含抗HER-2的多线治疗后免疫治疗的可能性。
而对于T-DM1的选取,Prof. Mien-Chie Hung认为首先要明确两个问题,第一是肝转移的患者需要检测HER-2是否阳性?第二是若为HER-2阳性,那么抗体是否仍可诱导内化?因为部分HER-2阳性肿瘤细胞可产生分子抗体阻止诱导内化,但机制却不明确。所以若患者为HER-2阳性且可以诱导内化,则T-DM1仍是可选择的方案。但若是HER-2阴性,则不再考虑抗HER-2治疗,可以考虑PARP抑制剂或免疫治疗。
王水教授则充分考虑到中国国情选择了吡咯替尼方案。对于可能出现曲妥珠单抗帕妥珠单抗出现耐药的晚期HER-2阳性患者,T-DM1虽是较好的方案,但在中国仍不可及,而基于徐兵河教授的一项研究现实,此类患者二线选择吡咯替尼联合卡培他滨的疗效要优于拉帕替尼联合化疗,中位PFS分别是18.1个月vs 7.0个月,所以在根据中国国情,将此方案提前到一线治疗也不失为一种选择。
总结
第一个病例为三阳性乳腺癌,因为复杂的合并症限制了用药的选择,所以不得不采用指南推荐外的新辅助治疗方案,通过个体化的精准治疗使患者取得了pCR。第二个病例是晚期HER-2阳性乳腺癌辅助治疗后肝转移,患者在曲妥珠单抗帕妥珠单抗耐药后,结合我国T-DM1不可及的国情而优选吡咯替尼方案,但我们不能放弃对此类患者的手术机会。所以结合各位专家的讨论,我们发现只有根据各医疗中心的临床现状才能为患者做出最好的个体化治疗选择,在遵循指南的基础上,精准治疗的道路还需要大家努力去探索。





 京公网安备 11010502033352号
京公网安备 11010502033352号