编者按:随着血液领域近年来治疗和基础研究的不断深入,新技术和药物应用给血液治疗领域不断带来革新,只有保持学习的热情才能提升我们的认知,为了紧跟临床研究发展动态,今后我们每月筛选在血液不同疾病领域对临床或者行业动态有影响的研究,以飨读者。淋巴瘤是最常见的血液恶性肿瘤,第一期我们来了解一下淋巴瘤领域在刚刚过去的二月有哪些进展,希望可以共同学习,砥砺前行。
 《HemaHub》第一期主要梳理
《HemaHub》第一期主要梳理
| 1 |
第一届欧洲CART细胞会议-CART细胞治疗淋巴瘤进展 |
| 2 |
Alisertib 单药治疗一线后复发的PTCL患者phaseIII临床研究 |
| 3 |
来那度胺联合美罗华治疗复发难治性PCNSL-DLBCL患者 |
| 4 |
Phase II DYNAMO 研究:Duvelisib 用于经过多线治疗R/RiNHL 患者 |
| 5 |
FDA授予polatuzumab vedotin治疗复发/难治性DLBCL获得优先审查 |
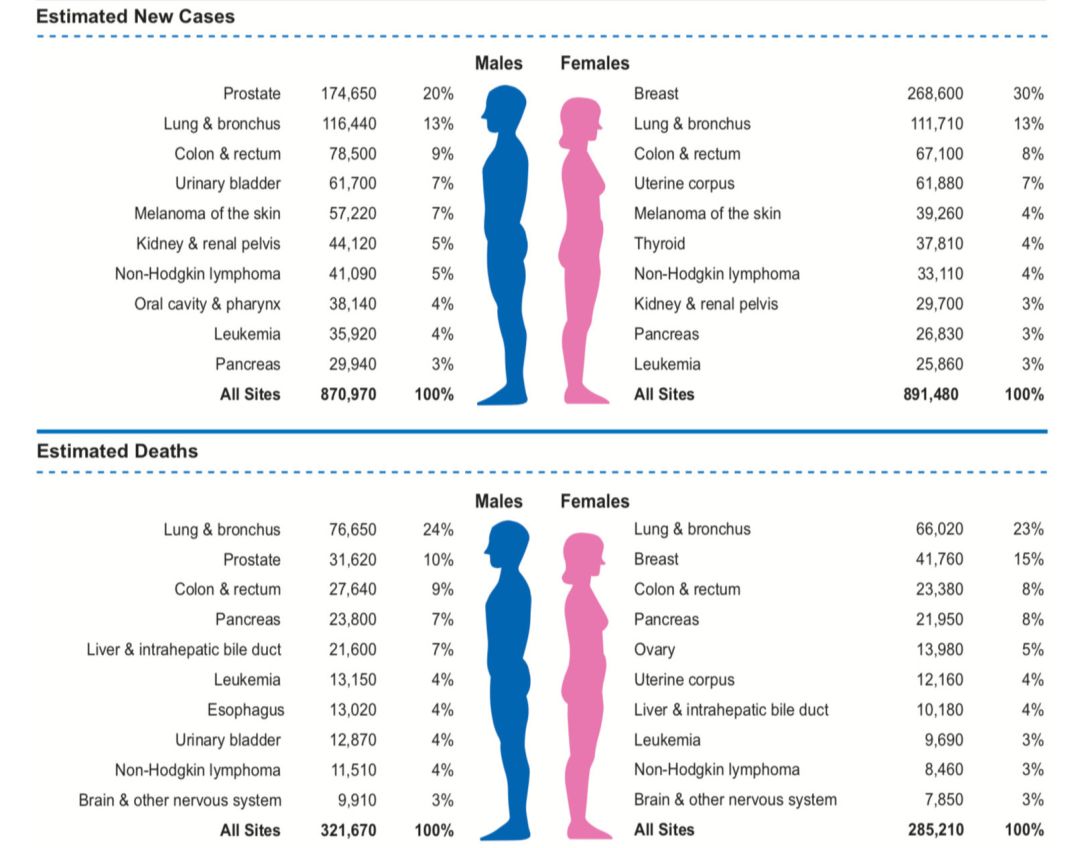 《Cancer Statistics,2019》:NHL发病率在所有瘤种排名第七位,死亡率排名第九。
《Cancer Statistics,2019》:NHL发病率在所有瘤种排名第七位,死亡率排名第九。
一第一届欧洲CAR T细胞会议--CAR T细胞治疗淋巴瘤进展

近年来,细胞治疗在恶性肿瘤领域开展得如火如荼。今年2月14-16日在巴黎召开的首届欧洲CAR-T细胞大会,是首个以CAR-T细胞治疗为核心的重要会议,也是同EMBT合作开展的一次国际盛会。大会主席由Prof.H Einsele与 Prof.C Chabannon共同担任,会议还邀请了Prof.Carl June、Prof.Michel Sadelain 和 Prof.Stanley Riddell进行主题报告。 淋巴瘤领域的分会上,Prof.MJ.Kersten开篇汇报了目前DLBCL的治疗现状:一线治疗4 x R-CHOP,二线或后线治疗为挽救性治疗,获得PR /CR患者进行自体干细胞移植(auto-SCT);随后她分享了Prof.Michael Crump发表在2017年Blood的SCHOLAR-1研究,首次对来自两个大型随机试验和两个学术数据库的难治性DLBCL结果进行患者水平分析,入组的861例患者中636例属于难治性DLBCL。难治性DLBCL患者至下一治疗周期的客观反应率是26%(总体是7%)、总体生存期中位数是6.3个月;1年OS为28%,2年OS为20%。 SCHOLAR-1研究分析显示,难治性非霍奇金淋巴瘤(NHL)患者的预后不良,并且有未被满足的治疗需求。
随后Kersten教授总结了近年来B细胞恶性肿瘤的治疗方法如何发展,并强调CAR T细胞过继免疫治疗是治疗B细胞恶性肿瘤患者的一种快速发展的治疗方法。
CAR T 治疗的异同点:
 Tisagenlecleucel,也称为KYMIRAH,是第一个在美国获得批准的CAR T疗法; 2018年5月,美国食品和药物管理局批准Tisagenlecleucel用于治疗2线以上的成人DLBCL患者,基于 JULIET研究的数据获批。
Tisagenlecleucel,也称为KYMIRAH,是第一个在美国获得批准的CAR T疗法; 2018年5月,美国食品和药物管理局批准Tisagenlecleucel用于治疗2线以上的成人DLBCL患者,基于 JULIET研究的数据获批。
 Axi-Cel,也称为YESCARTA,被批准用于治疗复发/难治性(R / R)成人B细胞淋巴瘤,包括DLBCL,原发性纵隔B细胞淋巴瘤(PMBCL)和转化的滤泡性淋巴瘤(TFL)。美国食品和药物管理局(FDA)根据ZUMA-1试验的结果批准适应症。
Axi-Cel,也称为YESCARTA,被批准用于治疗复发/难治性(R / R)成人B细胞淋巴瘤,包括DLBCL,原发性纵隔B细胞淋巴瘤(PMBCL)和转化的滤泡性淋巴瘤(TFL)。美国食品和药物管理局(FDA)根据ZUMA-1试验的结果批准适应症。
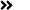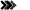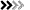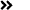 Liso-Cel是一种CD19定向的CAR T细胞产品,在治疗高风险的复发,难治性侵袭性NHL患者产生持久反应,尤其在DLBCL患者中出现6个月及以上缓解。基于根据TRANSCENDNHL 001试验报告。
Liso-Cel是一种CD19定向的CAR T细胞产品,在治疗高风险的复发,难治性侵袭性NHL患者产生持久反应,尤其在DLBCL患者中出现6个月及以上缓解。基于根据TRANSCENDNHL 001试验报告。
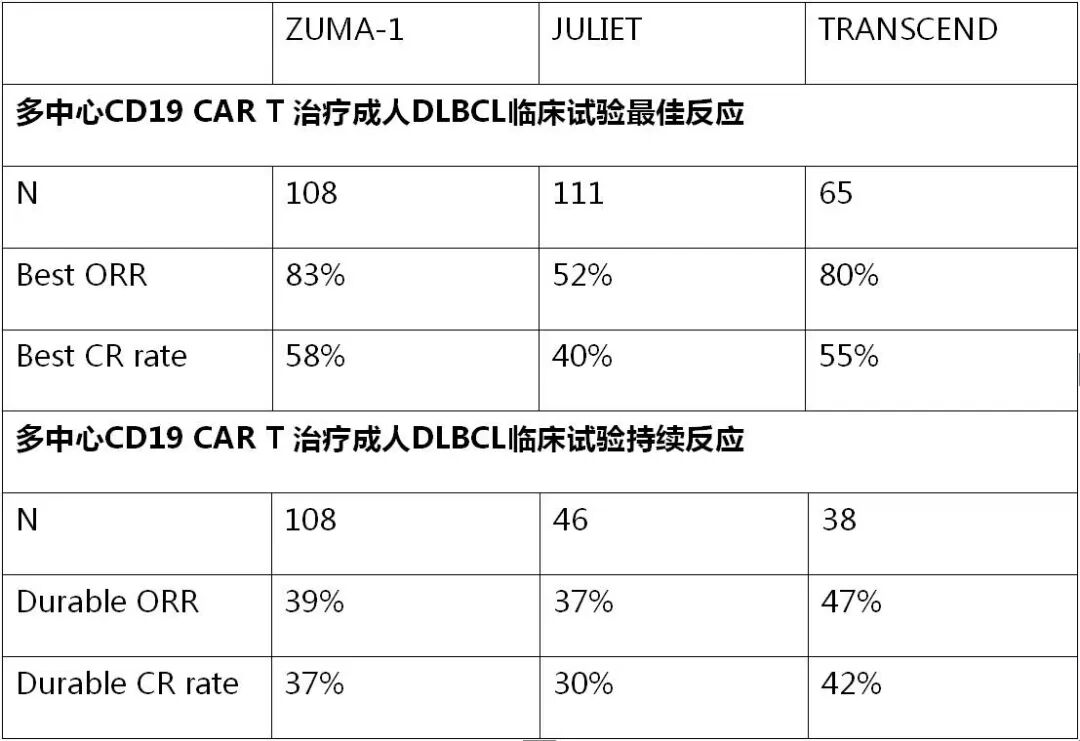 表1:总结ZUMA-1,JULIET,TRANSCENTD试验主要疗效数据
表1:总结ZUMA-1,JULIET,TRANSCENTD试验主要疗效数据
我们再来看Axi-Cel 真实世界数据: 美国17 个中心,共有274位患者接受治疗,Axi-Cel剂量为2 x 106 CAR T cells/kg 中位随访时间为: 3.9 个月,30天 ORR为191 (80%),30天 CR为113 (47%) 。
 图1 :Axi-Cel真实世界研究数据。
图1 :Axi-Cel真实世界研究数据。
Take home message: Kersten教授在结束讲话时指出,DLBCL中的CAR T细胞疗法已被证明可带来持久缓解。目前,对于复发难治的患者群体没有治愈性治疗方案,令人鼓舞的是,现实世界的经验表明CAR T疗法对于DLBCL患者是可行的治疗选择。
 图3 :CAR T治疗淋巴瘤的Take home message 。
图3 :CAR T治疗淋巴瘤的Take home message 。
二Alisertib 单药治疗一线后复发的PTCL患者phase III 临床研究
Aurora激酶是一种选择性调控细胞有丝分裂的极光激酶家族成员,Alisertib 是一种在研的Aurora A激酶抑制剂。今年2月美国纽约长老会医院O’Connor等教授发表在J Clin Oncol杂志的研究报告,在复发/难治性外周T细胞淋巴瘤(PTCL)患者中,Alisertib二线应用并不优于常规的单药化疗方案。
为评估Alisertib治疗复发/难治性PTCL的疗效,该随机Ⅲ期开放性研究入组:一线或一线以上治疗失败的成年患者, 随机给予口服Alisertib (50 mg bid,d1~7,q21)或研究者选择的静脉单药治疗(包括Pralatrexate 30 mg/m2,每周1次,持续6周,7周为1个周期;吉西他滨1000 mg/m2;或罗米地辛14 mg/m2,d1、8、15,q28)。独立中心评估肿瘤组织类型(疾病亚型)和影像结果。主要终点为总缓解率和无进展生存期(PFS)。
|
Alisertib
|
对照组
|
|
CR
|
18%
|
27%
|
|
中位PFS(天)
|
115
|
吉西他滨: 57
Pralatrexate: 101
罗米地辛: 242
|
表2 :治疗组和对照组主要疗效,治疗组并不必对照组效果更好。
最常见的不良事件为贫血(53% vs. 34%)和中性粒细胞减少症(47% vs. 31%),停药率分别为9%和14%。26例研究期间的死亡事件中,Alisertib组和对照组分别有3/11例和2/15例与治疗相关。
研究表明:在复发/难治性PTCL患者中,临床研究提示Alisertib方案同对照方案相比无统计学显著差异,未获得显著临床获益。
三来那度胺联合美罗华治疗复发难治性PCNSL-DLBCL 患者
原发中枢神经系统淋巴瘤(PCNSL)是一种少见的结外淋巴瘤类型,约占原发脑肿瘤的4%,占结外非霍奇金淋巴瘤(NHL)的4%~6%。PCNSL起病时病灶局限于脑-脊髓轴,包括脑实质、脊髓、眼、颅神经及脑膜。根据美国SEER登记系统的数据,近年来,>65岁人群PCNSL发病率上升,可能与人口老龄化有关。PCNSL主要为弥漫大B细胞淋巴瘤(DLBCL),占95%。PCNSL具有独特的临床及生物学表现,预后差于淋巴结起病的淋巴瘤及其他部位起病的结外淋巴瘤。另外,由于其发病率较低,开展随机对照临床研究较难,治疗相关的临床证据级别较低。因而对于临床医师来说,该病的诊断和治疗面临不少困难。
PCNSL中位发病年龄60岁,最常见症状为神经系统受损表现,头颅MRI的典型表现为颅内异常信号,T1低信号,T2低至同等信号,异常信号影的周围可见水肿带。一旦患者临床表现及头颅影像学检查提示淋巴瘤的可能,首选颅内占位立体定向活检。在颅内病灶病理学检查结果显示淋巴瘤诊断成立后,应尽快完成分期检查,包括头颅增强MRI、脑脊液细胞形态学、眼科裂隙灯、胸腹盆CT检查。PET-CT在PCNSL不做推荐。>60岁男性患者应行睾丸B超检查。通过上述检查以明确疾病侵犯范围,并鉴别淋巴瘤继发中枢神经系统侵犯。PCNSL的预后判断有国际结外淋巴瘤协作组(IELSG)和美国纪念斯隆-凯特琳癌症中心(MSKCC)预后评分系统,近年来,逐渐认识到起病时患者的年龄和一般状况是决定其预后最重要的两个因素。
今年发表在Ann Oncol杂志的研究介绍了在这个开放标签,多中心,单臂,前瞻性,II期试验中,静脉注射利妥昔单抗联合来那度胺(R)评估患有难治性/复发性(R / R)DLBCL-PCNSL或原发性玻璃体视网膜淋巴瘤的患者(PVRL)包括在这项前瞻性II期研究中。 诱导处理包括8个28天周期 R2(利妥昔单抗375 / m2 IV,D1; 来那度胺20毫克/天,D1-21为一个周期1; 和25毫克/天,后续D1-21); 在有反应的患者中,诱导理后进行维持阶段,包括12个28天的周期单用来那度胺(10毫克/天,D1-21)。 主要终点是总体响应率诱导结束时的(ORR)(P0 = 10%; P1 = 30%)。该研究的主要终点是总体反应率(ORR)。包括次要终点:无进展生存期(PFS),总生存期(OS)和安全性。
入组条件:如果患者至少18岁,有R / R PCNSL或PVRL,则符合条件之前用高剂量(HD)甲氨蝶呤治疗(MTX≥1.5g/ m2并且,患者PCNSL,HD阿糖胞苷(≥2g/ m2)。 接受过HDT + ASCT或脑放疗的患者(RT)符合条件。 继发性中枢神经系统淋巴瘤不符入组条件。
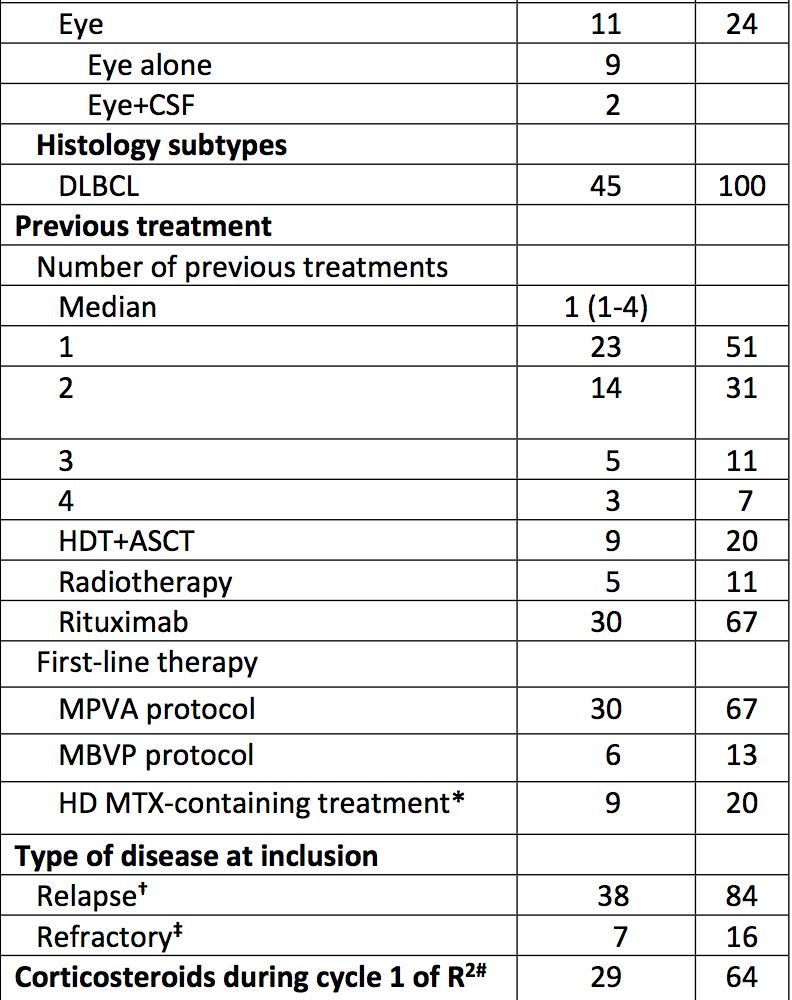 表3:原发中枢神经系统的淋巴瘤患者临床特征和既往治疗方案(REVRI study)
表3:原发中枢神经系统的淋巴瘤患者临床特征和既往治疗方案(REVRI study)
结果:共入组50名患者。 其中45名患者(PCNSL,N = 34; PVRL,N = 11)可评估反应。 诱导结束时可评估患者的ORR为35.6%(95%CI,21.9-51.2)和意向治疗分析中的32.0%(95%CI,21.9-51.2),包括13例完全反应(CR)/uCR(uCR; 29%)和3例部分反应(PR; 7%)。 诱导期间的最佳反应为18 CR / uCR(40%)和12 PR(27%)。中位随访19.2个月(范围1.5-31),中位无进展生存期(PFS)总生存期(OS)为7.8个月(95%CI,3.9-11.3)和17.7个月(95%CI,12.9-尚未到达)。 没有观察到意外的毒性。
研究同时发现外周基线CD4 / CD8比率影响PFS(若CD4 /CD8≥1.6 中位PFS = 9.5个月,95%CI: 8.1-14.8;若CD4 / CD8<1.6中位PFS = 2.8个月95%CI,的1.1-7.8,P= 0.03)。 意味着未来检测CD4 / CD8也许也是预测预后的指标之一。
结论: 研究表明R / R DLBCL-PCNSL患者中的R显示出良好的活性。 然而,需要进一步的研究来验证这些结果,可能是R与基于MTX的化学疗法一起提供更好的治疗一线PCNSL的方案。
四Phase II DYNAMO试验:Duvelisib治疗经过大量预处理的R / R iNHL患者,为该患者群体提供新的治疗选择
DUVELISIB已被美国食品和药物管理局(FDA)批准用于复发或难治性(R / R)慢性淋巴细胞白血病或小淋巴细胞淋巴瘤(CLL / SLL)和R / R滤泡性淋巴瘤(FL)患者,经过两线或两线以上治疗。 该研究结果在今年JCO杂志报道,在这个开放标签的全球II期试验(NCT01882803)中,评估duvelisib单剂,口服的情况和安全性,R / R惰性非霍奇金淋巴瘤(iNHL)的患者中本研究的主要终点是由国际独立审查委员会(IRC)评估的总体回应率(ORR)工作组(IWG)恶性淋巴瘤的标准。 次要终点,包括无进展生存期(PFS)和总生存期(OS)。
入组:共有129例iNHL,FL (n=83例),SLL (n=28例) Marginal zone lymphoma (MZL; n=18例),在28天的周期内每天两次自行给予25 mg口服duvelisib,直至疾病进展(PD),不可接受的毒性或死亡。
结果:ORR (总体人群): 47% (95% CI, 38 56%),不同亚型iNHL: FL: 42% SLL: 68% MZL: 39%。中位 OS: 28.9 个月 (95% CI, 21.4 not estimable) 1年 OS: 77%。在既往多线治疗的R / R iNHL患者中,主要在治疗的前两个月内,对duvelisib的治疗有反应,中位持续时间为10个月。 R / R iNHL患者的Duvelisib单药治疗在iNHL亚型(FL,MZL,CLL)中表现出类似的不良事件。
口服duvelisib单药治疗在既往多线治疗,复发难治性iNHL中表现出有临床意义,并且安全性可控,与先前的观察结果一致。 Duvelisib可为该患者群体提供新的口服治疗选择,其中许多人是老年人并且需要额外的治疗。
五FDA授予Polatuzumab vedotin治疗复发/难治性DLBCL获得优先审查
2019年2月19日,美国食品和药物管理局(FDA)接受BLA(Biologics License Application)并对Polatuzumab vedotin进行优先审查, Polatuzumab vedotin是一款用于治疗非霍奇金淋巴瘤(NHL)的同类首款抗CD79b抗体药物偶联物苯达莫司汀和利妥昔单抗(ADC)。CD79b蛋白具高度特异性,并在大多数的B细胞NHL中表达。Polatuzumab vedotin与CD79b结合并通过靶向途径破坏这些B细胞,能特异性杀死肿瘤细胞而较少影响正常细胞。
 图4:Polatuzumab vedotin作用机制图
图4:Polatuzumab vedotin作用机制图
Polatuzumab vedotin的BLA基于来自全球随机Ib / II期GO29365研究的数据,该研究评估了polatuzumab vedotin与bendamustin和利妥昔单抗(BR)联合使用的耐受性,安全性和活性,与之相比BR患者 - 经过处理的R / R DLBCL。 该试验的结果显示,与单独使用BR相比,polatuzumab vedotin联合BR可改善中位无进展生存期(7.6个月vs 2.0个月)。 此外,治疗组之间的感染和输血率相似。 此外,治疗组之间的感染和输血率相似。 然而,与单独使用BR的患者相比,接受polatuzumab vedotin联合BR的患者3-4级血细胞减少率更高。
根据研究结果显示该疗法“改善临床结果,包括一些患有复发或难治性弥漫性大B细胞淋巴瘤的患者的生存”。
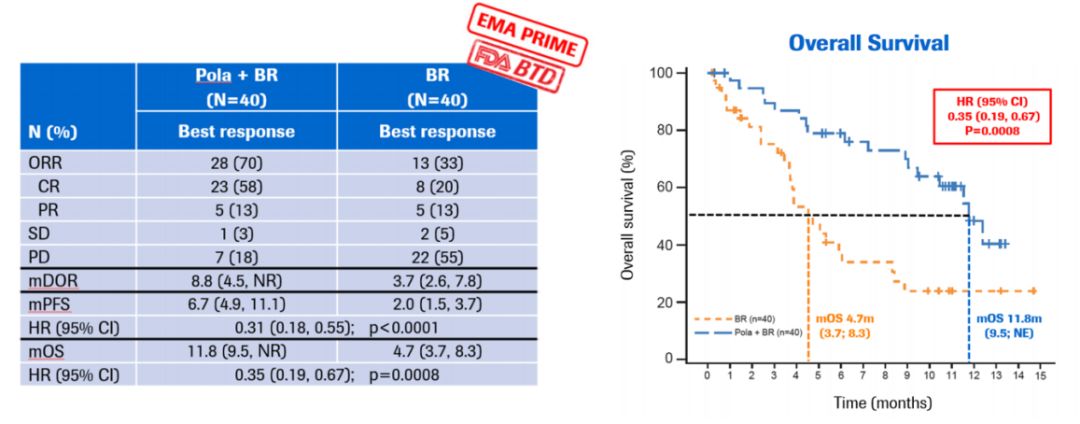 图5:Polatuzumab vedotin 治疗R/R DLBCL的临床研究数据(来自Sehn L. H. et al., ASH 2017,Abstract2821)
图5:Polatuzumab vedotin 治疗R/R DLBCL的临床研究数据(来自Sehn L. H. et al., ASH 2017,Abstract2821)
Ref :
1.O Connor O.A et al. Randomized Phase III Study of Alisertib or Investigator’s Choice (Selected Single Agent) in Patients With Relapsed or Refractory Peripheral T-Cell Lymphoma. J Clin Oncol. 2019 Feb 1:JCO1800899.DOI: 10.1200/JCO.18.00899
2.Flinn I.W. et al.DYNAMO: A Phase II Study of Duvelisib (IPI-145) in Patients With Refractory Indolent Non-Hodgkin Lymphoma. J Clin Oncol . 2019 Feb 11:JCO1800915. DOI: 10.1200/JCO.18.00915 [Epub ahead of print].
3.Ghesquieres H.et al. Lenalidomide in Combination with Intravenous Rituximab (REVRI) in Relapsed/Refractory Primary CNS Lymphoma or Primary Intraocular Lymphoma: a Multicenter Prospective "Proof of Concept" Phase II Study of the French Oculo-Cerebral Lymphoma (LOC) Network and the Lymphoma Study Association (LYSA). Ann Oncol . 2019 Jan 29. DOI: 10.1093/annonc/mdz032 [Epub ahead of print].
4.朱军. 我如何治疗原发中枢神经系统淋巴瘤 [J] . 中华血液学杂志,2018,39( 5 ): 372-375.
5.GlobeNewswire. FDA grants priority review to Roche’s polatuzumab vedotin in previously treated aggressive lymphoma. [Accessed 2019 Feb 19]
6.Sehn L. H. et al., Polatuzumab Vedotin + BR in R/R DLBCL: Survival ASH 2017,Abstract 2821





 京公网安备 11010502033352号
京公网安备 11010502033352号